Le début de la vie : L'embryon précoce est à la place du conducteur
Les blastoïdes ont réglé le dilemme de la "poule ou de l'œuf"
On pense souvent que l'embryon précoce est fragile et a besoin d'être soutenu. Pourtant, dès les premiers stades de son développement, il a le pouvoir de nourrir le futur placenta et d'instruire l'utérus pour qu'il puisse se nicher. En utilisant des "blastoïdes", des modèles d'embryons in vitro formés avec des cellules souches, le laboratoire de Nicolas Rivron à l'IMBA a montré que les premiers signaux moléculaires qui induisent le développement du placenta et préparent l'utérus proviennent de l'embryon lui-même. Ces résultats, publiés aujourd'hui dans Cell Stem Cell, pourraient contribuer à une meilleure compréhension de la fertilité humaine.
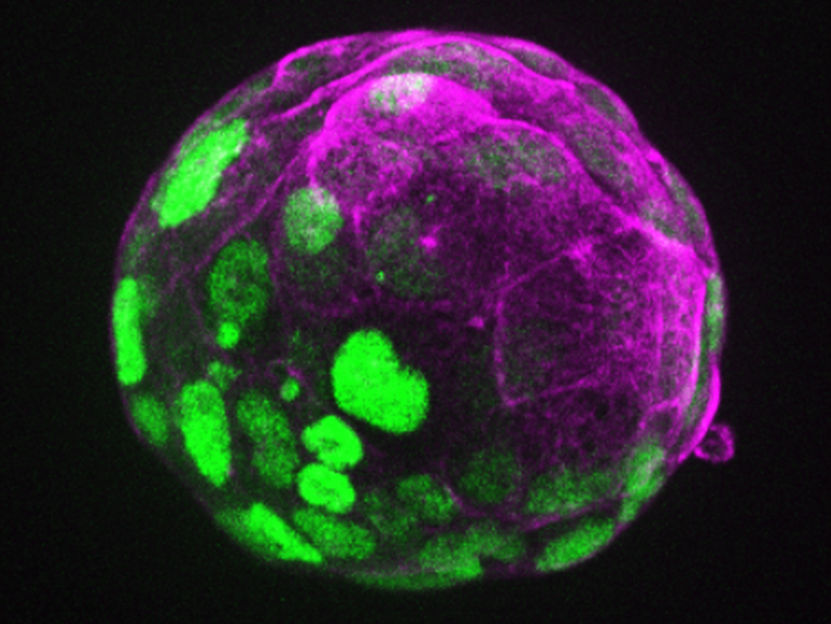
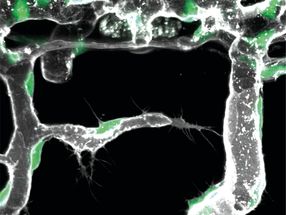
Un axe d'expression des protéines dans un blastoïde de souris
©Rivron/CellStemCell/IMBA
Qui s'occupe de qui au début de la vie ?
Le placenta et l'utérus nourrissent et abritent le fœtus. Mais la situation au tout début du développement, lorsque le blastocyste flotte encore dans l'utérus, n'était pas claire jusqu'à présent. Aujourd'hui, le groupe de recherche de Nicolas Rivron à l'IMBA (Institut de biotechnologie moléculaire de l'Académie autrichienne des sciences) a découvert les principes de base du développement précoce en utilisant des blastoïdes.
Les blastoïdes sont des modèles in vitro du blastocyste, l'embryon de mammifère dans les premiers jours suivant la fécondation. Ces modèles d'embryons ont d'abord été développés par le laboratoire Rivron à partir de cellules souches de souris (Nature, 2018), puis de cellules souches humaines (Nature, 2021). Les blastoïdes offrent une alternative éthique à l'utilisation d'embryons pour la recherche et, surtout, permettent de multiples découvertes.
Aujourd'hui, les blastoïdes ont réglé un dilemme "de la poule ou de l'œuf". En utilisant des blastoïdes de souris, les chercheurs ont découvert que la partie embryonnaire précoce (~10 cellules) donne des instructions pour la formation de la future partie placentaire (~100 cellules) et la modification des tissus utérins. "En agissant ainsi, l'embryon investit dans son propre avenir : il favorise la formation des tissus qui prendront bientôt en charge son développement. L'embryon est aux commandes, il donne des instructions pour la création d'un environnement de soutien", déclare Nicolas Rivron.
En effet, l'équipe a découvert plusieurs molécules sécrétées par les quelques cellules à partir desquelles le fœtus se développe, les épiblastes. Ils ont observé que ces molécules indiquent à d'autres cellules, les trophoblastes qui formeront plus tard le placenta, de s'auto-renouveler et de proliférer, deux propriétés des cellules souches qui sont essentielles à la croissance du placenta.
L'équipe a également découvert que ces molécules incitent les trophoblastes à sécréter deux autres molécules, WNT6 et WNT7B. WNT6 et WNT7B indiquent à l'utérus d'envelopper le blastocyste. "D'autres chercheurs avaient déjà vu que les molécules WNT étaient impliquées dans la réaction utérine. Nous montrons maintenant que ces signaux sont des WNT6/7B et qu'ils sont produits par les trophoblastes du blastocyste pour notifier à l'utérus de réagir. La pertinence pourrait être élevée car nous avons vérifié que ces deux molécules sont également exprimées par les trophoblastes du blastocyste humain", déclare Nicolas Rivron.
L'équipe a fait ses découvertes en partie en examinant le degré d'implantation des blastoïdes de souris dans un modèle de souris à implantation in vivo. "J'ai été très surpris par l'efficacité avec laquelle nos blastoïdes se sont implantés dans l'utérus. Et en modifiant les propriétés des trophoblastes à l'intérieur des blastoïdes, y compris les niveaux de sécrétion de WNT6/7B, nous avons pu clairement modifier la taille du cocon utérin", explique le co-premier auteur Jinwoo Seong, un post-doctorant du laboratoire de Rivron, qui a réalisé ces expériences.
L'implantation étant le goulot d'étranglement des grossesses humaines - environ 50 % des grossesses échouent à ce moment-là - et WNT6 et WNT7B étant également présents dans les blastocystes humains, ces résultats pourraient expliquer pourquoi, parfois, les choses tournent mal. "Nous répétons actuellement ces expériences avec des blastoïdes et des cellules utérines humaines, le tout dans un plat, afin d'estimer la conservation de ces principes de base du développement. Ces découvertes pourraient à terme contribuer à l'amélioration des procédures de FIV, à la mise au point de médicaments de fertilité et de contraceptifs", explique Nicolas Rivron.
Le travail d'équipe a également été mené par deux autres co-premiers auteurs : Javier Frías Aldeguer, un ancien étudiant en doctorat, et Viktoria Holzmann, une étudiante en doctorat actuelle. "La compréhension de ces principes fondamentaux du développement embryonnaire contribuera à terme à donner aux femmes les moyens de mieux maîtriser leur fertilité, ce qui non seulement améliorerait le planning familial mais aurait également un impact sur l'égalité des sexes dans la société", déclare Viktoria Holzmann.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.