L'étude des cristaux pourrait résoudre le mystère de l'ADN
Le laboratoire de Rice saisit des détails inédits de la réplication et fournit des indices sur la façon dont les mutations peuvent se produire.
Lorsque les cellules se reproduisent, les mécanismes internes qui copient l'ADN se déroulent presque toujours correctement. Des bioscientifiques de l'université de Rice ont découvert un détail minuscule qui permet de comprendre comment le processus peut déraper.
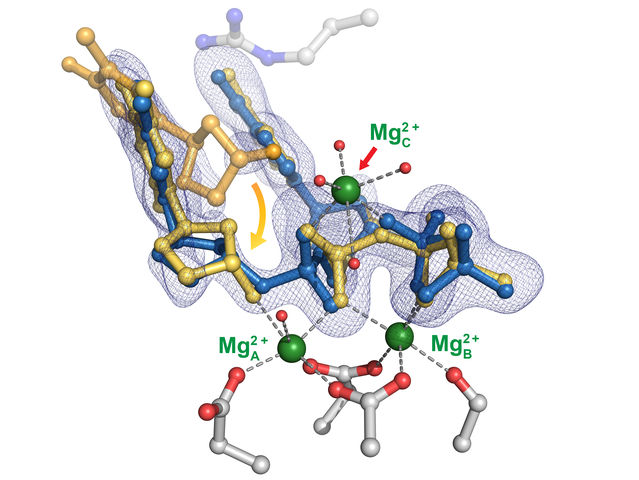
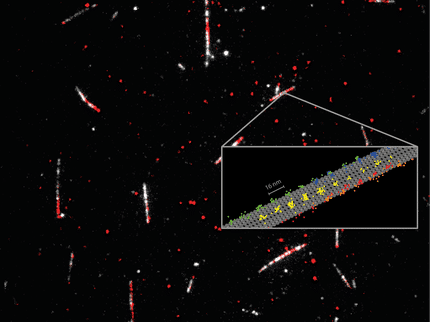
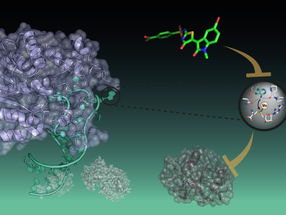
La structure de poly-eta, une enzyme qui aide à diriger la réplication de l'ADN. Une étude de cristallographie à résolution temporelle de l'enzyme à l'université Rice a révélé l'importance d'un troisième ion métallique qui contribue à stabiliser le processus, garantissant ainsi sa précision.
Yang Gao Lab/Rice University
Leur étude des enzymes a révélé que la présence d'un ion métallique central essentiel à la réplication de l'ADN semble également impliquée dans la mauvaise incorporation, c'est-à-dire le mauvais ordonnancement des nucléotides sur les nouveaux brins.
L'observation rapportée dans Nature Communications pourrait aider à trouver des traitements pour les mutations génétiques et les maladies qu'elles provoquent, notamment le cancer.
Le biologiste structurel de l'université du Rice, Yang Gao, l'étudiant diplômé Caleb Chang et l'ancienne étudiante Christie Lee Luo ont utilisé la cristallographie à résolution temporelle pour analyser les enzymes flexibles appelées polymérases lorsqu'elles se plient et se tordent pour réassembler rapidement des brins complets d'ADN à partir d'un pool de nucléotides C, G, A et T.
Toutes les protéines impliquées dans la réplication de l'ADN s'appuient sur des ions métalliques - magnésium ou manganèse - pour catalyser le transfert des nucléotides à leurs positions appropriées le long du brin, mais la question de savoir si deux ou trois ions sont impliqués a longtemps fait l'objet d'un débat.
L'équipe de Rice semble avoir tranché en étudiant une polymérase connue sous le nom d'eta, une enzyme de synthèse des translesions qui protège des lésions induites par les ultraviolets. Les personnes présentant des mutations sur le gène poly-eta ont souvent une prédisposition au xeroderma pigmentosum et au cancer de la peau, selon les chercheurs.
M. Gao a déclaré que les polymérases typiques ressemblent à une forme droitière, et il pense à elles comme à une main réelle : "Elles ont un domaine de la paume qui contient le site actif, un domaine du doigt qui se referme pour interagir avec la nouvelle paire de bases, et un domaine du pouce qui lie l'amorce/le modèle d'ADN", a-t-il expliqué.
Mais jusqu'à présent, les scientifiques ne pouvaient que deviner certains détails du mécanisme bien caché par lequel les polymérases font leur travail, et échouent parfois. Le type de cristallographie à résolution temporelle utilisé dans le laboratoire de Gao a permis aux chercheurs d'analyser des protéines cristallisées à 34 étapes intermédiaires pour définir la position de leurs atomes avant, pendant et après la synthèse de l'ADN.
"Cette réaction cinétique est difficile à capturer parce qu'il y a beaucoup d'atomes et qu'ils travaillent très vite", a déclaré Gao, professeur adjoint de biosciences qui a rejoint Rice en tant que boursier CPRIT en 2019. "Nous n'avons jamais su comment les atomes se déplacent ensemble parce que l'information spatiale manquait. Le fait de geler les protéines et un substrat de petite molécule nous permet de capturer cette réaction catalytique pour la première fois."
L'étude a débouché sur leur théorie selon laquelle le premier des trois atomes métalliques de l'éta favorise la liaison des nucléotides, tandis que le second est la clé pour maintenir le nucléotide et l'amorce sur la bonne voie en stabilisant la liaison des nucléotides libres à l'amorce située sur la moitié existante du nouveau brin (alias le substrat). Les amorces sont de courts brins d'ADN qui marquent l'endroit où les polymérases commencent à enchaîner les nouveaux nucléotides.
"Ce n'est que lorsque les deux premiers ions métalliques sont en échec que le troisième peut venir et mener la réaction à son terme", a déclaré Chang, suggérant que le processus pourrait être universel parmi les polymérases.
Les chercheurs ont également remarqué que le polyéthylène contient un motif qui le rend vulnérable au désalignement des amorces, ce qui augmente les risques de mauvaise incorporation.
"Il s'agit, en premier lieu, d'un mécanisme fondamental de la vie", a déclaré Gao. "L'ADN doit être copié avec précision, et les erreurs peuvent conduire à des maladies humaines. Les personnes qui étudient ces enzymes savent que pour la synthèse de l'ADN, elles font toujours beaucoup, beaucoup mieux que ce qu'elles devraient, car la quantité d'énergie disponible pour choisir la bonne paire de bases est très limitée."
Pour Gao, le véritable intérêt réside dans la démonstration de la capacité de la cristallographie à résolution temporelle à observer l'ensemble d'un processus catalytique dans les détails atomiques.
"Cela nous permet de voir exactement ce qui se passe dans un processus catalytique dynamique au fil du temps", a-t-il déclaré.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.