Une nouvelle ère d'édition du génome mitochondrial a commencé
Les scientifiques réussissent à convertir les bases A en G, la dernière pièce manquante du puzzle de la technologie d'édition de gènes.
Des chercheurs du Centre d'ingénierie du génome, au sein de l'Institut des sciences fondamentales, ont mis au point une nouvelle plate-forme d'édition de gènes appelée "désaminases liées à un activateur de transcription", ou TALED. Les TALED sont des éditeurs de bases capables d'effectuer la conversion des bases A en G dans les mitochondries. Cette découverte a été le point culminant d'un voyage de plusieurs décennies pour guérir les maladies génétiques humaines, et le TALED peut être considéré comme la dernière pièce manquante du puzzle de la technologie d'édition de gènes.
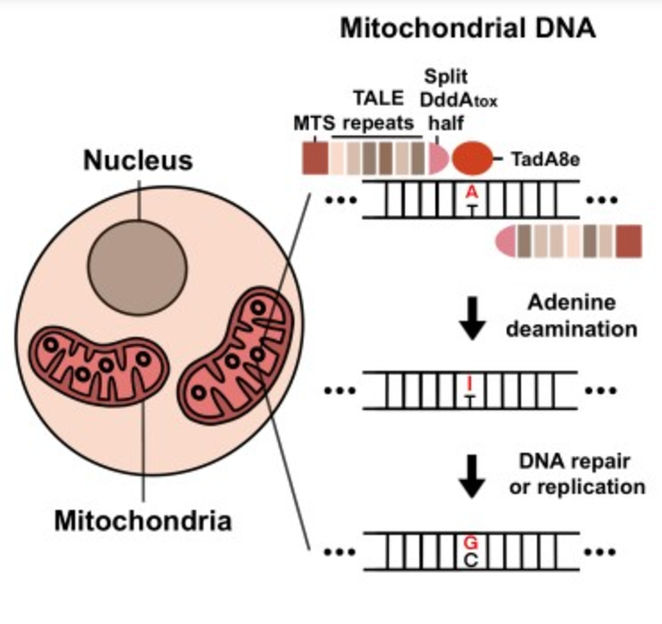
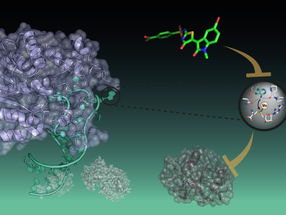
Résumé graphique montrant comment les TALEDs fonctionnent dans les mitochondries. D'abord, l'adénine est désaminée en inosine. Ensuite, l'inosine est convertie en guanine par la réparation ou la réplication de l'ADN.
Institute for Basic Science
Depuis l'identification de la première enzyme de restriction en 1968, l'invention de la réaction en chaîne par polymérase (PCR) en 1985 et la démonstration de l'édition du génome par CRISPR en 2013, chaque nouvelle découverte révolutionnaire en biotechnologie a amélioré notre capacité à manipuler l'ADN, le plan de la vie. En particulier, le développement récent du système CRISPR-Cas, ou "ciseaux génétiques", a permis une édition complète du génome des cellules vivantes. Cela a ouvert de nouvelles possibilités pour traiter des maladies génétiques auparavant incurables en éliminant les mutations de notre génome.
Si l'édition des gènes a largement réussi à modifier le génome nucléaire des cellules, les scientifiques n'ont en revanche pas réussi à modifier les mitochondries, qui possèdent également leur propre génome. Les mitochondries, appelées "centrales électriques des cellules", sont de minuscules organites dans les cellules qui servent d'usines de production d'énergie. Comme il s'agit d'un organite important pour le métabolisme énergétique, si le gène est muté, il provoque de graves maladies génétiques liées au métabolisme énergétique.
Le directeur du Centre d'ingénierie génomique, KIM Jin-Soo, explique : "Il existe des maladies héréditaires extrêmement graves dues à des défauts de l'ADN mitochondrial. Par exemple, la neuropathie optique héréditaire de Leber (LHON), qui provoque une cécité soudaine des deux yeux, est causée par une simple mutation ponctuelle de l'ADN mitochondrial." Une autre maladie liée au gène mitochondrial est l'encéphalomyopathie mitochondriale avec acidose lactique et épisodes de type AVC (MELAS), qui détruit lentement le cerveau du patient. Certaines études suggèrent même que des anomalies de l'ADN mitochondrial pourraient également être responsables de maladies dégénératives telles que la maladie d'Alzheimer et la dystrophie musculaire.
Le génome mitochondrial est hérité de la lignée maternelle. Il existe 90 mutations ponctuelles pathogènes connues dans l'ADN mitochondrial, ce qui, au total, affecte au moins un individu sur 5 000. De nombreux outils d'édition du génome existants n'ont pas pu être utilisés en raison des limitations de la méthode d'administration aux mitochondries. Par exemple, la plateforme CRISPR-Cas n'est pas applicable pour éditer ces mutations dans les mitochondries, car l'ARN guide est incapable de pénétrer dans l'organite lui-même.
"Un autre problème est qu'il y a une pénurie de modèles animaux de ces maladies mitochondriales. En effet, il n'est actuellement pas possible de créer les mutations mitochondriales nécessaires à la création de modèles animaux", ajoute le directeur Kim. "L'absence de modèles animaux rend très difficile le développement et l'expérimentation de thérapies pour ces maladies."
En tant que telle, une technologie fiable pour modifier l'ADN mitochondrial est l'une des dernières frontières de l'ingénierie du génome qui doit être explorée afin de vaincre toutes les maladies génétiques connues, et les scientifiques les plus éminents du monde s'efforcent depuis des années d'en faire une réalité.
En 2020, des chercheurs dirigés par David R. LIU, du Broad Institute de Harvard et du MIT, ont créé un nouvel éditeur de bases, appelé DddA-derived cytosine base editors (DdCBEs), capable d'effectuer la conversion C-T de l'ADN dans les mitochondries. Cela a été rendu possible par la création d'une nouvelle technologie d'édition de gènes appelée édition de base, qui convertit une base nucléotidique unique en une autre sans casser l'ADN. Cependant, cette technique avait aussi ses limites. Non seulement elle est limitée à la conversion de C en T, mais elle se limite surtout au motif TC, ce qui en fait un convertisseur TC-TT. Cela signifie qu'elle ne peut corriger que 9 des 90 (= 10%) mutations ponctuelles mitochondriales pathogènes confirmées. Pendant longtemps, on a cru que la conversion A-G de l'ADN mitochondrial était impossible.
Le premier auteur CHO Sung-Ik a déclaré : "Nous avons commencé à réfléchir à des moyens de surmonter ces limites. C'est ainsi que nous avons pu créer une nouvelle plateforme d'édition de gènes appelée TALED, capable de réaliser une conversion de A en G. Notre nouvel éditeur de bases a considérablement élargi le champ d'application de notre technologie. Notre nouvel éditeur de bases a considérablement élargi la portée de l'édition du génome mitochondrial. Cela peut apporter une grande contribution non seulement à la création d'un modèle de maladie mais aussi au développement d'un traitement." À noter que la capacité d'effectuer des conversions de A à G dans l'ADNmt humain permettrait à elle seule de corriger 39 (= 43 %) des 90 mutations pathogènes connues.
Les chercheurs ont créé TALED en fusionnant trois composants différents. Le premier composant est un effecteur de type activateur de transcription (TALE), qui est capable de cibler une séquence d'ADN. Le deuxième composant est TadA8e, une adénine désaminase qui facilite la conversion A-G. Le troisième composant, DddAtox, est une cytosine désaminase qui rend l'ADN plus accessible à TadA8e.
Un aspect intéressant de TALED est la capacité de TadA8e à effectuer une édition de A à G dans les mitochondries, qui possèdent de l'ADN double brin (ADNdb). Il s'agit d'un phénomène mystérieux, car TadA8e est une protéine connue pour être spécifique à l'ADN simple brin. Le directeur Kim a déclaré : "Personne n'avait encore pensé à utiliser TadA8e pour effectuer une édition de base dans les mitochondries, car elle est censée être spécifique à l'ADN simple brin. C'est cette approche sortant des sentiers battus qui nous a vraiment aidés à inventer TALED."
Les chercheurs ont émis l'hypothèse que le DddAtox permet à l'ADNdb d'être accessible en déroulant transitoirement le double brin. Cette fenêtre temporelle fugace mais temporaire permet à TadA8e, une enzyme à action super rapide, d'effectuer rapidement les modifications nécessaires. En plus de modifier les composants de TALED, les chercheurs ont également mis au point une technologie capable de modifier simultanément les bases A à G et C à T, ainsi que les bases A à G uniquement.
Le groupe a démontré cette nouvelle technologie en créant un seul clone dérivé de cellules contenant les modifications souhaitées de l'ADNmt. En outre, les TALED se sont avérés ne pas être cytotoxiques et ne pas provoquer d'instabilité dans l'ADNmt. De plus, il n'y a pas eu d'édition hors cible indésirable dans l'ADN nucléaire et très peu d'effets hors cible dans l'ADNmt. Les chercheurs cherchent maintenant à améliorer les TALED en augmentant l'efficacité et la spécificité de l'édition, ce qui ouvrirait la voie à la correction des mutations de l'ADNmt causant des maladies chez les embryons, les fœtus, les nouveau-nés ou les patients adultes. Le groupe se concentre également sur le développement de TALED adaptés à l'édition des bases A à G de l'ADN du chloroplaste, qui code des gènes essentiels à la photosynthèse chez les plantes.
William I. Suh, le communicateur scientifique de l'Institut des sciences fondamentales, a déclaré : "Je pense que l'importance de cette découverte est comparable à l'invention de la LED bleue, qui a reçu un prix Nobel en 2014. Tout comme la LED bleue a été la pièce finale du puzzle qui nous a permis de disposer d'une source de lumière LED blanche à haute efficacité énergétique, on s'attend à ce que TALED ouvre une nouvelle ère de l'ingénierie des génomes."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.