Descubrimiento en la investigación del Parkinson: Los lípidos influyen en la formación de cúmulos de proteínas
Los hallazgos podrían abrir nuevos enfoques para diagnosticar y tratar la enfermedad de Parkinson
Después del Alzheimer, el Parkinson es la enfermedad neurodegenerativa más común del mundo. La padecen más de seis millones de personas en todo el mundo. En esta enfermedad, las proteínas alfa-sinucleína forman estructuras similares a hilos llamadas fibrillas. Cuando estas fibrillas se agrupan, probablemente dañan las células nerviosas. Un equipo de investigadores ha demostrado por primera vez cómo los lípidos se unen a la superficie de las fibrillas e influyen en la disposición de las proteínas de la sinucleína dentro de las mismas. Según ha demostrado, el candidato a fármaco anle138b se une a un agujero en forma de tubo dentro de dicha fibrilla lipídica. Los hallazgos de los investigadores podrían abrir nuevos enfoques para diagnosticar y tratar la enfermedad de Parkinson.

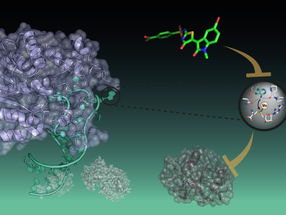
Las proteínas de la alfa-sinucleína (verde) forman largas fibrillas helicoidales (arriba). Durante la formación de las fibrillas, las proteínas extraen lípidos (gris/rojo) de las membranas lipídicas (abajo) e incorporan estos lípidos a la estructura de las fibrillas.
Benedikt Frieg, Forschungszentrum Jülich
Es una enfermedad con muchas caras: En la fase progresiva del Parkinson, las extremidades comienzan a temblar, los músculos se vuelven rígidos y los movimientos se ralentizan. En algunos casos, se producen trastornos cognitivos o depresión. Actualmente no hay cura para el Parkinson, ni para las enfermedades relacionadas con la demencia de cuerpos de Lewy y la atrofia multisistémica, en las que también aparecen fibrillas de alfa-sinucleína.
Depósitos visibles en el cerebro
Una característica llamativa de la enfermedad de Parkinson son los cúmulos de proteína alfa-sinucleína en el cerebro. Al igual que otras proteínas, la alfa-sinucleína está formada por largas cadenas de aminoácidos que deben plegarse correctamente en tres dimensiones para cumplir sus funciones. Con una forma incorrecta, pueden "apilarse" formando fibrillas muy ordenadas. Las fibrillas, a su vez, pueden formar agregados aún mayores. Los científicos sospechan que la acumulación de la proteína alfa-sinucleína mal plegada perjudica la función de las células nerviosas y contribuye a su muerte.
Sin embargo, en su plegado correcto, la alfa-sinucleína es indispensable para las células nerviosas. Se une a las membranas lipídicas y participa en el transporte de vesículas y la liberación de las sustancias mensajeras que transportan en las células nerviosas. "Sin embargo, los lípidos también parecen interactuar con las alfa-sinucleínas mal plegadas", informa Gunnar Schröder, jefe de grupo del Forschungszentrum Jülich y profesor de la Universidad Heinrich Heine de Düsseldorf. "Hace tiempo que se sospecha que las interacciones entre los lípidos y las proteínas alfa-sinucleína mal plegadas podrían desempeñar un papel en el desarrollo de la enfermedad de Parkinson. Pero hasta ahora sabemos muy poco sobre esta relación", explica Bert de Groot, jefe del grupo de investigación del Instituto Max PIanck (MPI) de Ciencias Multidisciplinares de Göttingen.
Los lípidos influyen en la formación de fibrillas
Los científicos han conseguido ahora colmar esta laguna de conocimientos. Mediante el uso de la criomicroscopía electrónica, han conseguido visualizar por primera vez cómo las moléculas lipídicas se unen a la superficie de las fibrillas y conectan las unidades entre sí. Mediante sofisticadas simulaciones informáticas combinadas con espectroscopia de resonancia magnética nuclear en estado sólido, el equipo también pudo mostrar cómo interactúan los elementos lipídicos y proteicos dentro de las fibrillas.
Sorprendentemente, se formaron varias fibrillas completamente nuevas en presencia de lípidos. "Nuestros hallazgos subrayan que necesitamos estudiar las fibrillas de alfa-sinucleína también en presencia de lípidos si queremos entender la base molecular de las patologías relacionadas con la alfa-sinucleína", comenta el director del Max Planck, Christian Griesinger.
El candidato a fármaco contra el Parkinson anle138b se une a las fibrillas lipídicas
"El prometedor candidato a fármaco anle138b también se une a las estructuras lipídicas de la alfa-sinucleína. El fármaco se adhiere a las cavidades tubulares dentro de la fibrilla lipídica", dice Loren Andreas, líder del grupo de investigación en el MPI. "También encontramos tales cavidades en otras proteínas que se pliegan mal y están asociadas a enfermedades neurodegenerativas, por ejemplo la tau y la proteína priónica. La cuestión que nos interesa ahora es saber si el anle138b se adhiere a ellas de forma similar y, por tanto, podría proporcionar también un enfoque diagnóstico y terapéutico para dichas enfermedades."
Anle138b fue desarrollado en 2013 por el equipo de Griesinger junto con Armin Giese y sus colegas de la Universidad Ludwig Maximilians de Múnich. En pruebas con ratones, el compuesto retrasa con éxito la progresión de la enfermedad de Parkinson. Actualmente está siendo desarrollado por MODAG AG en colaboración con la empresa Teva. En un estudio clínico de fase I, demostró ser tolerable para los seres humanos, lo que permite realizar más ensayos clínicos en curso.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.