La lucha contra el cáncer de ovario
Complejo de tricarbonilo de renio con actividad antitumoral dirigido a la biogénesis de los clústeres de Fe-S
Los complejos metálicos han pasado a ocupar el centro de la escena en la búsqueda de nuevos fármacos contra el cáncer que estén lo más libres posible de efectos secundarios. En la revista Angewandte Chemie, un equipo de investigación ha descrito ahora cómo una dosis muy baja de un complejo metálico de renio interfiere en el metabolismo celular hasta tal punto que mata las células de cáncer de ovario.
© Wiley-VCH
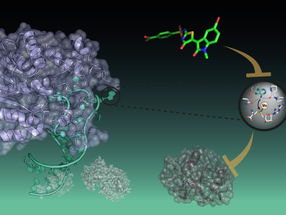
El cisplatino fue el primer fármaco antitumoral con contenido metálico y desde entonces se han descubierto otros. Recientemente, se ha encontrado un nuevo fármaco antitumoral potencial en TRIP, un complejo especial de renio carbonilo. El TRIP provoca una rápida agregación de proteínas, lo que somete al retículo endoplásmico (RE) -donde se produce la síntesis, modificación y plegado de las proteínas- a una gran presión, hiperactivando la respuesta de las proteínas no plegadas (UPR). La UPR es una respuesta celular a la acumulación de un gran número de proteínas incorrectamente plegadas en el RE. Esto provoca la muerte celular programada (apoptosis) de las células tumorales.
Un equipo dirigido por Samuel M. Meier-Menches, de la Universidad de Viena (Austria), y Justin J. Wilson, de la Universidad de Cornell (Ithaca, NY/EE.UU.), ha analizado con más detalle los efectos de TRIP mediante la quimioprotésica. Este método se utiliza para identificar qué proteínas celulares se unen a un fármaco. A pesar de los amplios efectos tóxicos de TRIP, el equipo fue capaz de identificar 89 proteínas celulares individuales, dependientes de la dosis, en una línea de células de cáncer de ovario, lo que se denomina el paisaje objetivo de TRIP.
Además, el equipo caracterizó la respuesta de la línea celular viva de cáncer al tratamiento con TRIP mediante la elaboración de perfiles proteómicos. Esto implica comparar el proteoma, es decir, todas las proteínas de las células, con y sin la adición de varias dosis del fármaco y observar las diferencias en las concentraciones de las proteínas individuales.
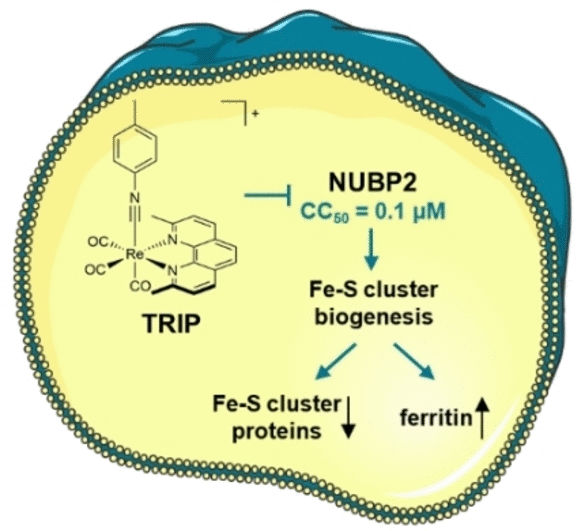
En conjunto, estos datos apuntan al factor de biogénesis de los clusters de Fe-S NUBP2 como probable punto de partida de los procesos celulares desencadenados por TRIP. Los clusters de Fe-S son complejos formados por varios átomos de hierro y azufre. Como cofactores, desempeñan un papel importante en muchas reacciones enzimáticas, como la cadena respiratoria. NUBP2 es esencial para la producción de proteínas con clusters de Fe-S. El tratamiento con TRIP redujo significativamente el número de proteínas Fe-S en las células de cáncer de ovario. La cantidad de la proteína de almacenamiento de hierro, la ferritina, aumentó drásticamente. La falta de proteínas con clústeres de Fe-S para la respiración celular fue corroborada por la bioenergética de las células tumorales.
TRIP interrumpe la biogénesis de los cúmulos de Fe-S en las células de cáncer de ovario en dosis tan pequeñas que no son generalmente citotóxicas. Esto lo convierte en un interesante punto de partida para el desarrollo de un fármaco antitumoral selectivo con pocos efectos secundarios no deseados. Este nuevo método de investigación combinado podría utilizarse ampliamente para estudiar la polifarmacología (efecto sobre varias dianas) de los candidatos a fármacos basados en metales.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.