Primera imagen del receptor de células T unido a un antígeno a resolución atómica
Bases para nuevos enfoques terapéuticos dirigidos a enfermedades graves
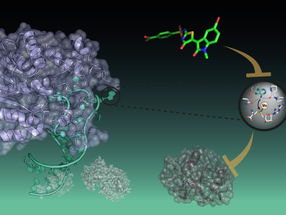
Las células T son las herramientas personalizadas de nuestro sistema inmunitario para luchar contra las enfermedades infecciosas y las células tumorales. En su superficie, estos glóbulos blancos especiales llevan un receptor que reconoce los antígenos. Con la ayuda de la criomicroscopía electrónica, los bioquímicos y biólogos estructurales de la Universidad Goethe de Fráncfort, en colaboración con la Universidad de Oxford y el Instituto Max Planck de Biofísica, pudieron visualizar por primera vez el complejo completo del receptor de las células T con el antígeno unido a una resolución atómica. De este modo, ayudaron a comprender un proceso fundamental que puede allanar el camino hacia nuevos enfoques terapéuticos dirigidos a enfermedades graves.
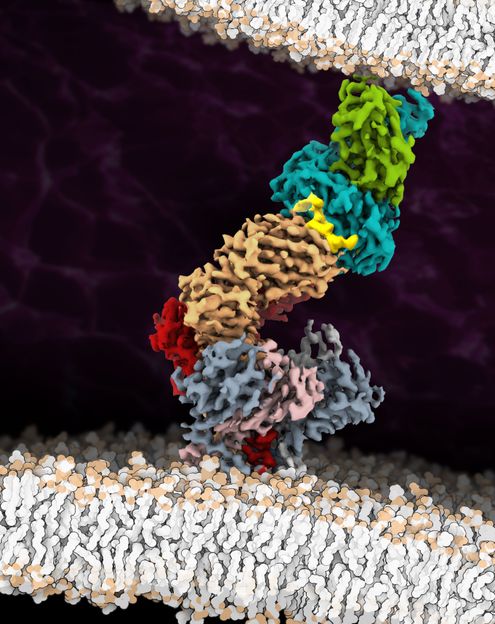
La estructura crio-EM del complejo del receptor de células T (TCR) completamente ensamblado con un péptido asociado al tumor/ligando del MHC proporciona importantes conocimientos sobre la biología de la señalización del TCR.
Robert Tampé, Goethe-Universität
FRANKFURT. El sistema inmunitario de los vertebrados es una poderosa arma contra los patógenos externos y las células cancerosas. Las células T desempeñan un papel crucial en este contexto. Llevan en su superficie un receptor especial llamado receptor de células T que reconoce los antígenos -pequeños fragmentos proteicos de bacterias, virus y células corporales infectadas o cancerosas- que se presentan mediante complejos inmunitarios especializados. El receptor de las células T es, por tanto, el principal responsable de distinguir entre lo "propio" y lo "extraño". Tras la unión de un antígeno adecuado al receptor, se desencadena una vía de señalización dentro de la célula T que "arma" a la célula para la tarea correspondiente. Sin embargo, el modo en que se activa esta vía de señalización ha sido un misterio hasta ahora, a pesar de que el receptor de células T es uno de los complejos de proteínas receptoras más estudiados.
Muchos receptores de superficie transmiten señales al interior de la célula cambiando su estructura espacial tras la unión del ligando. Hasta ahora se suponía que este mecanismo también afectaba al receptor de las células T. Investigadores dirigidos por Lukas Sušac, Christoph Thomas y Robert Tampé, del Instituto de Bioquímica de la Universidad Goethe de Fráncfort, en colaboración con Simon Davis, de la Universidad de Oxford, y Gerhard Hummer, del Instituto Max Planck de Biofísica, han conseguido visualizar por primera vez la estructura de un complejo de receptor de células T unido a la membrana con antígeno ligado. La comparación de la estructura unida al antígeno captada mediante criomicroscopía electrónica con la de un receptor sin antígeno proporciona las primeras pistas sobre el mecanismo de activación.
Para el análisis estructural, los investigadores eligieron un receptor de células T utilizado en la inmunoterapia para el tratamiento del melanoma y que había sido optimizado para este fin en varios pasos de forma que se uniera a su antígeno lo más estrechamente posible. Un reto especial en el camino hacia la determinación de la estructura fue aislar de la membrana celular todo el conjunto del receptor de antígeno, formado por once subunidades diferentes. "Hasta hace poco, nadie creía que fuera posible extraer de la membrana un complejo proteico de membrana tan grande de forma estable", afirma Tampé.
Una vez que lo consiguieron, los investigadores utilizaron un truco para pescar aquellos receptores de la preparación que habían sobrevivido al proceso y seguían siendo funcionales: debido a la fuerte interacción entre el complejo de receptores y el antígeno, pudieron "pescar" uno de los complejos de receptores inmunitarios más importantes desde el punto de vista médico. Las imágenes recogidas posteriormente en el criomicroscopio electrónico proporcionaron una visión innovadora sobre el funcionamiento del receptor de células T, como resume Tampé: "Sobre la base de nuestro análisis estructural, pudimos mostrar cómo el receptor de células T se ensambla y reconoce los antígenos y formular la hipótesis de cómo se desencadena la transducción de señales tras la unión del antígeno". Según sus resultados, la gran sorpresa es que, evidentemente, no hay ningún cambio significativo en la estructura espacial del receptor tras la unión del antígeno, ya que ésta era prácticamente la misma con y sin antígeno.
La cuestión que queda por resolver es cómo la unión del antígeno podría, en cambio, conducir a la activación de las células T. Se sabe que el correceptor CD8 se acerca al receptor de células T tras la unión del antígeno y estimula la transferencia de grupos fosfato a su parte intracelular. Los investigadores suponen que esto conduce a la formación de estructuras que excluyen a las enzimas que escinden los grupos fosfato (fosfatasas). Si faltan estas fosfatasas, los grupos fosfato permanecen estables en el receptor de células T y pueden desencadenar el siguiente paso de la cascada de señalización. "Nuestra estructura es un modelo para futuros estudios sobre la activación de las células T", está convencido Tampé. "Además, es un estímulo importante para emplear el receptor de células T en un contexto terapéutico para tratar infecciones, cáncer y enfermedades autoinmunes".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.