El descubrimiento de CRISPR abre el camino a un nuevo método de análisis de COVID
LEOPARD tiene el potencial de revolucionar los diagnósticos
¿Estoy infectado por el SARS-CoV-2? ¿Es una de las variantes peligrosas? Poder responder a estas y otras preguntas con una sola prueba diagnóstica eficaz puede ser decisivo para calibrar la propagación de la enfermedad y seleccionar la terapia adecuada. En un estudio publicado en la revista "Science", los investigadores de Würzburg del Instituto Helmholtz para la Investigación de Infecciones basadas en el ARN (HIRI), una sede del Centro Helmholtz para la Investigación de Infecciones (HZI) en cooperación con la Universidad Julius Maximilians (JMU), abordan este reto con un nuevo descubrimiento de CRISPR que tradujeron en una plataforma de diagnóstico llamada LEOPARD.

Imagen simbólica
pixabay.com
La mayoría de los diagnósticos moleculares convencionales suelen detectar un único biomarcador relacionado con la enfermedad. Grandes ejemplos son las pruebas de PCR que se utilizan actualmente para diagnosticar el COVID-19 mediante la detección de una secuencia específica del SARS-CoV-2. Estos métodos denominados singleplex proporcionan resultados fiables porque están "calibrados" para un único biomarcador. Sin embargo, para determinar si un paciente está infectado por una nueva variante del SARS-CoV-2 o por un patógeno completamente diferente, es necesario sondear muchos biomarcadores diferentes a la vez.
Científicos del Instituto Helmholtz para la Investigación de Infecciones Basadas en el ARN (HIRI) y de la Universidad Julius Maximilians (JMU) de Würzburg han allanado ahora el camino hacia una plataforma de diagnóstico completamente nueva con LEOPARD. Se trata de un método basado en CRISPR que es altamente multiplexable, con el potencial de detectar una variedad de biomarcadores relacionados con la enfermedad en una sola prueba.
Cómo funciona LEOPARD
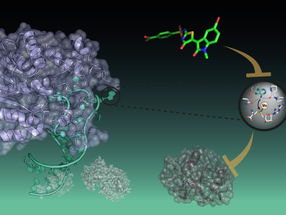
LEOPARD, que significa "Leveraging Engineered tracrRNAs and On-target DNAs for PArallel RNA Detection", se basa en el descubrimiento de que el corte del ADN por Cas9 puede vincularse a la presencia de un ácido ribonucleico (ARN) específico. Este vínculo permite a LEOPARD detectar muchos ARN a la vez, lo que abre oportunidades para la detección simultánea de ARN de virus y otros patógenos en una muestra de paciente.
El estudio publicado en "Science" fue iniciado por Chase Beisel, profesor de la JMU y jefe del grupo de investigación del HIRI, y la profesora Cynthia Sharma, del Instituto de Biología Molecular de la Infección (IMIB) de la JMU. "Con LEOPARD, logramos detectar fragmentos de ARN de nueve virus diferentes", afirma Beisel. "También pudimos diferenciar el SARS-CoV-2 y una de sus variantes en una muestra de un paciente, a la vez que confirmamos que cada muestra fue recogida correctamente del paciente".
Antecedentes
CRISPR-Cas9 se conoce principalmente como una herramienta biomolecular para la edición del genoma. En este caso, las CRISPR-Cas9 funcionan como tijeras moleculares que cortan secuencias específicas de ADN. Estas mismas tijeras son utilizadas naturalmente por las bacterias para cortar el ADN asociado a los virus invasores. Tanto para editar genomas como para eliminar virus, el corte de Cas9 está dirigido por ARN guía. Los ARN guía que se encuentran en las bacterias deben emparejarse con otro ARN llamado tracrRNA. La pareja de ARN puede entonces trabajar con Cas9 para dirigir el corte del ADN.
Un descubrimiento inesperado
Se pensaba que el tracrRNA sólo se emparejaba con los ARN guía procedentes del sistema antiviral. Sin embargo, los científicos de Würzburg descubrieron que el tracrRNA se emparejaba con otros ARN, convirtiéndolos en ARN guía. Cynthia Sharma, catedrática de Biología Molecular de la Infección II en el IMIB y portavoz del Centro de Investigación de Enfermedades Infecciosas (ZINF) de la JMU, se mostró asombrada por este descubrimiento: "Cuando buscamos ARNs que se unieran a Cas9 en nuestro organismo modelo Campylobacter, sorprendentemente encontramos que detectamos no sólo ARNs guía, sino también otros fragmentos de ARN en la célula que parecían ARNs guía. El tracrRNA se emparejaba con estos ARN, dando lugar a ARN guía "no canónicos" que podían dirigir el corte del ADN por parte de Cas9".
La plataforma de diagnóstico LEOPARD se basa en este descubrimiento. "Descubrimos cómo reprogramar los tracrRNAs para decidir qué ARNs se convierten en ARNs guía", dice Beisel. "Mediante el seguimiento de un conjunto de ADNs coincidentes, podemos determinar qué ARNs estaban presentes en una muestra basándonos en qué ADNs se cortan". Como parte de la pandemia en curso, LEOPARD podría permitir a un médico averiguar si el paciente está infectado por el SARS-CoV-2, si se trata de una variante única y si la muestra se tomó correctamente o debe repetirse, todo ello en una sola prueba."
En el futuro, el rendimiento de LEOPARD podría eclipsar incluso las pruebas PCR multiplexadas y otros métodos. "La tecnología tiene el potencial de revolucionar el diagnóstico médico, no sólo para las enfermedades infecciosas y las resistencias a los antibióticos, sino también para el cáncer y las enfermedades genéticas raras", afirma Oliver Kurzai, director del Instituto de Higiene y Microbiología de la JMU, que proporcionó muestras de pacientes para el estudio.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Chunlei Jiao, Sahil Sharma, Gaurav Dugar, Natalia L. Peeck, Thorsten Bischler, Franziska Wimmer, Yanying Yu, Lars Barquist, Christoph Schoen, Oliver Kurzai, Cynthia M. Sharma*, Chase L. Beisel*; "Non-canonical crRNAs derived from host transcripts enable multiplexable RNA detection by Cas9"; Science, April 2021.