Llegar al corazón de una enzima
Descifrando el corazón de la NCT: Los rayos X ayudan a arrojar luz sobre la estructura
Un equipo dirigido por Oliver Daumke en el MDC ha determinado la estructura tridimensional de la acetiltransferasa NatC en un artículo publicado en Nature Communications. Esta enzima modifica las proteínas celulares para que puedan realizar sus funciones correctamente. En las células cancerosas, sin embargo, la NatC es a menudo hiperactiva.
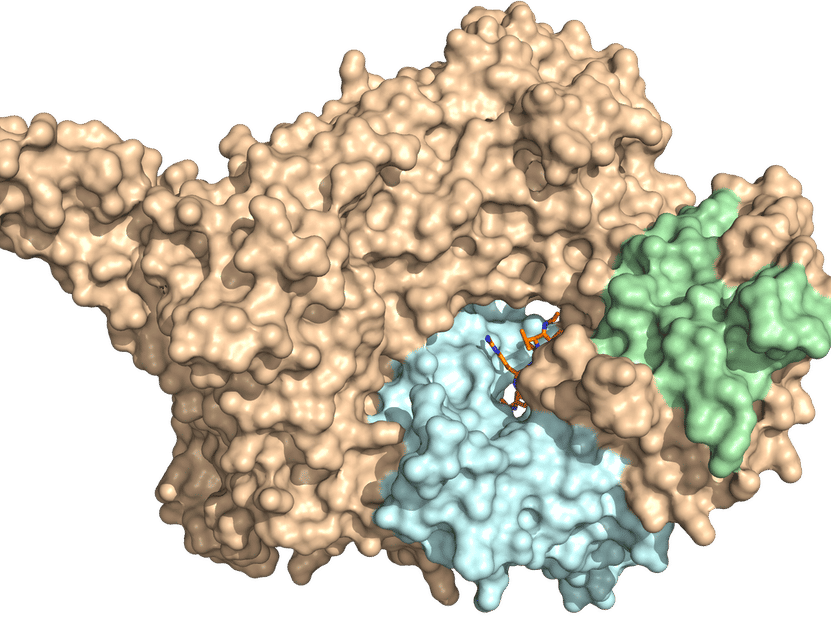
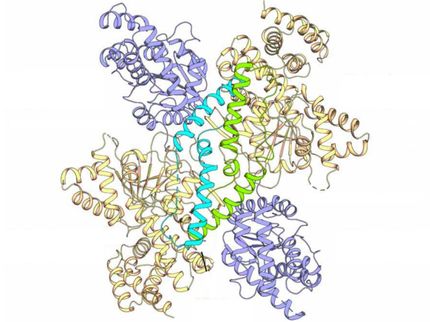
La estructura cristalina de rayos X de NatC. El complejo de tres partes consiste en una subunidad catalítica (azul claro) y una subunidad auxiliar grande y otra pequeña (marrón y verde, respectivamente). Se requiere una punta prominente de NatC para la interacción con el ribosoma.
© AG Daumke, MDC
Pequeños cambios pueden hacer una gran diferencia. Y esto también es cierto para las proteínas: Si sólo un átomo de hidrógeno al final de estas enormes moléculas se cambia por un grupo acetilo, esta nueva estructura química le da a la proteína propiedades completamente diferentes. Ahora puede, por ejemplo, ser capaz de interactuar con otras proteínas, su vida útil puede cambiar, o de repente puede ser capaz de buscar objetivos completamente nuevos en la célula.
Un importante mecanismo de regulación celular
La acetilación de las proteínas, que es el término científico para el intercambio de un átomo de hidrógeno por un grupo acetilo, es por lo tanto un importante mecanismo de regulación de las células. La acetilación puede ponerse en marcha mediante un grupo de enzimas denominadas acetiltransferasas N-terminales, o NAT para abreviar. Estas enzimas están acetilando el N-terminal de una proteína, donde se encuentra un aminoácido con un grupo amina libre.
Hay un gran número de NATs diferentes en las células humanas, pero hasta hace poco, sólo conocíamos la estructura detallada de unos pocos de ellos. La estructura precisa de la acetiltransferasa NatC ha sido ahora "decodificada" por un equipo dirigido por el Profesor Oliver Daumke, jefe del Laboratorio de Biología Estructural del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC), junto con investigadores de la Charité - Universitätsmedizin de Berlín.
La mayoría de las proteínas en los humanos son acetiladas
El autor principal del estudio es el biólogo estructural Dr. Stephan Grunwald, un antiguo estudiante de doctorado y ahora un postdoctorado en el equipo de Daumke. "La acetilación N-terminal es una modificación de la proteína muy común - y por lo tanto extremadamente importante para las muchas funciones celulares", dice Grunwald. "En los humanos, entre el 80 y el 90 por ciento de todas las proteínas se modifican de esta manera."
Grunwald comenzó tomando bacterias de la especie Escherichia col i(E. coli), e introdujo en ellas las tres subunidades NatC. "Estas bacterias produjeron grandes cantidades de NatC para nosotros, que luego purificamos, cristalizamos y examinamos más de cerca usando cristalografía de rayos X", informa Grunwald. Ya se sabía que el NatC consiste en un catalizador y dos subunidades auxiliares. "Pero primero tuvimos que averiguar cómo están organizadas estas subunidades en el complejo NatC, y qué funciones cumple cada una de ellas", explica Grunwald.
Los rayos X ayudan a arrojar luz sobre la estructura
Para la cristalografía de rayos X, es necesario primero cristalizar la enzima mezclándola con aditivos químicos particulares. "Terminas con cristales de una décima de milímetro de largo, cada uno de los cuales contiene muchos millones de complejos de NatC que están dispuestos de manera bastante uniforme", dice Grunwald. Los cristales se congelan rápidamente a -196 grados centígrados, después de lo cual son bombardeados con intensos rayos X producidos por un acelerador de partículas, como el de BESSY II en Berlín-Adlershof.
"Basándonos en el patrón de difracción de los rayos X, podemos sacar conclusiones sobre la estructura tridimensional de la proteína", explica Daumke. Al hacerlo, él y su equipo descubrieron que la subunidad catalítica de NatC, donde tiene lugar la acetilación de las proteínas, está rodeada por una pequeña y una muy grande subunidad auxiliar. "Esta última sirve como una especie de andamio para toda la enzima", dice Daumke.
La enzima espera al final de la línea de producción
Los investigadores también pudieron descubrir otros secretos de la acetiltransferasa. "Ya sabíamos que la NatC se adhiere a los ribosomas, que son las fábricas de proteínas de la célula", informa Grunwald. "Con la ayuda de ensayos de unión, pudimos mostrar que se requiere una región de punta de NatC con carga positiva para la unión del ribosoma. Se sienta allí, casi como si estuviera al final de una línea de producción, y espera a que una nueva proteína aún no doblada se extienda". NatC puede decir de los primeros cuatro aminoácidos de la nueva proteína producida si debe acetilarla o no.
Descifrando el corazón de NatC
Con la ayuda de este nuevo conocimiento estructural, los investigadores fueron capaces de obtener una visión detallada del "corazón que late" de NatC, la subunidad catalítica. "Cambiamos los aminoácidos individuales varias veces en el centro catalítico de la enzima", informa Grunwald. Por lo tanto, él y sus colegas ahora saben exactamente cómo es el corazón de NatC y el mecanismo por el cual la acetilación se produce allí.
El bloqueo del centro catalítico de NatC
Este conocimiento podría ser importante algún día para la terapia del cáncer, por ejemplo. "La NatC es a menudo hiperactiva en ciertas células malignas", dice Grunwald. "Así que es posible, al menos hipotéticamente, desarrollar drogas que bloqueen el centro catalítico de la enzima - y así también detener el crecimiento del tumor." Sin embargo, primero, el biólogo estructural quiere pasar sus hallazgos a los biólogos celulares: "Ahora que hemos determinado la estructura exacta de la NatC, pueden encontrar las funciones precisas de la enzima en el cuerpo humano."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.