La estructura de la ATPasa, la turbina más pequeña del mundo, resuelve
Ubicación del poro de transición de permeabilidad encontrado
El químico ATP, trifosfato de adenosina, es el combustible que impulsa toda la vida. El ATP se encuentra en todas las formas de vida conocidas, donde proporciona energía para impulsar la contracción muscular, la propagación de impulsos y la síntesis química. A pesar del papel central del ATP, la estructura de la enzima generadora de ATP, la F1Fo-ATP sintasa, en los mamíferos, incluidos los humanos, no se ha conocido hasta ahora. Ahora, Leonid Sazanov y su grupo en el Instituto de Ciencia y Tecnología de Austria (IST Austria) reportan la primera estructura completa de la sintasa F1Fo-ATP de mamíferos. Esta estructura también establece un debate sobre cómo se forma el poro de transición de permeabilidad, una estructura implicada en la muerte celular, el cáncer y los ataques cardíacos.

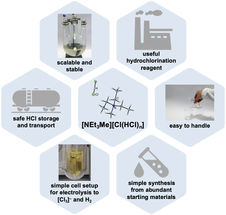
Filas de ATP sintasa como se formarían en las crestas de las membranas mitocondriales. El ATP, el ADP y los lípidos se muestran en colores brillantes.
Gergely Pinke / IST Austria
La ATP sintasa también se conoce como complejo V de la cadena respiratoria, una serie de complejos de proteínas en la membrana de las mitocondrias. Esta cadena respiratoria crea un gradiente de protones, que la ATP sintasa utiliza para fabricar ATP. Anteriormente, Sazanov fue el primero en resolver la estructura proteica del complejo bacteriano I, y el primero en resolver la estructura del complejo I de un mamífero. En el nuevo estudio, Sazanov y los miembros del laboratorio Gergely Pinke y Long Zhou recurrieron al complejo V de un mamífero, la estructura final no resuelta de la cadena respiratoria de un mamífero. "La F1Fo-ATP sintasa es una de las enzimas más importantes de la Tierra. Proporciona energía para la mayoría de las formas de vida, incluidos nosotros los humanos, pero hasta ahora, no sabíamos completamente cómo funciona", explica Sazanov.
La rotación enturbia la imagen
Como ya se conoce la estructura del dominio soluble F1, parecido a un hongo, Sazanov y su equipo miraron particularmente al dominio Fo, incrustado en la membrana mitocondrial. Aquí, los protones se translocan en la interfaz entre el llamado anillo c, un anillo formado por subunidades de proteína idénticas, y el resto de Fo. Los protones se mueven a través de la membrana cuando cada subunidad c recoge un protón en un lado de la membrana, rota con el anillo, y libera el protón en el otro lado. Este anillo c está unido al eje central de la F1 y su rotación genera ATP dentro de la F1. Para resolver la estructura del dominio Fo y todo el complejo, los investigadores estudiaron la enzima de las mitocondrias de las ovejas usando microscopía crioelectrónica. Y aquí, la ATP sintasa plantea un problema especial: debido a su rotación, la ATP sintasa puede detenerse en tres posiciones principales, así como en los subproductos. "Es muy difícil distinguir entre estas posiciones, atribuyendo una estructura a cada posición que la ATP sintasa puede tomar. Pero logramos resolver esto computacionalmente para construir la primera estructura completa de la enzima", añade Sazanov.
Ubicación del poro de transición de permeabilidad encontrado
En su estructura de alta resolución de Fo, los investigadores encontraron que el anillo c está tapado por dos lípidos, uno de cada lado de la membrana. Mientras que el lípido superior (frente a F1) rota junto con el eje, el lípido inferior no rota, ya que probablemente esté conectado al dominio Fo a través de un "aparato de gancho".
Esta estructura recién descubierta arroja luz sobre una controversia en la biología: cómo y dónde se abre el llamado poro de transición de permeabilidad. Este poro está relacionado con la muerte celular y se abre, por ejemplo, durante los accidentes cerebrovasculares y los ataques cardíacos. Hasta ahora se sabía que el poro se forma en las mitocondrias en respuesta a altos niveles de calcio, pero la ubicación exacta del poro seguía siendo desconocida. Ahora, usando la estructura completamente resuelta de la F1Fo, Sazanov y su grupo pueden describir cómo se forma el poro en la sintetasa F1Fo-ATP: Cuando el calcio se une en la subunidad F1, se induce un gran cambio conformacional. El complejo tiene que acomodar este cambio, y al hacerlo, tira del aparato de gancho. El aparato a su vez tira del tapón de lípidos en la parte inferior de la Fo, iniciando la apertura de los poros. "Cuando el poro está abierto durante un período de tiempo más largo, el anillo c se desestabiliza y la formación de los poros se vuelve irreversible", explica Sazanov. "Este modelo es consistente con todos los datos disponibles de los mutantes. Para estar completamente seguro de que así es como se forma el poro de transición de permeabilidad, habría que resolver la estructura de la ATP sintasa durante las transiciones inducidas por el calcio, lo que estamos haciendo ahora".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.