Cómo se puede evitar que el coronavirus invada una célula anfitriona
El estudio muestra que la inhibición de dos proteasas de la célula huésped podría ayudar a prevenir la COVID-19
¿Cómo se puede evitar que el nuevo coronavirus entre en una célula anfitriona para frustrar la infección? Un equipo de científicos biomédicos ha hecho un descubrimiento que apunta a una solución.

La foto muestra a Maurizio Pellecchia (izquierda) y Carlo Baggio.
Carrie Rosema
Los científicos, dirigidos por Maurizio Pellecchia en la Escuela de Medicina de la Universidad de California, Riverside, informan en la revista Molecules que dos proteasas - enzimas que descomponen las proteínas - localizadas en la superficie de las células huéspedes y responsables de procesar la entrada viral podrían ser inhibidas. Tal inhibición de la proteasa evitaría que el SARS-CoV2, el coronavirus responsable del COVID-19, invada la célula huésped.
Glicoproteína de punta
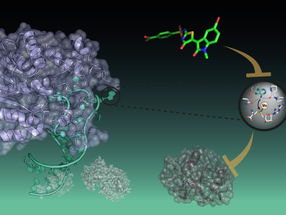
La superficie exterior de los coronavirus contiene una proteína crítica llamada glicoproteína de punta, o glicoproteína S. Responsable de dar al coronavirus su típica forma de corona, la glicoproteína S es esencial para la entrada de partículas virales en las células huésped. Sin embargo, las proteasas de las células anfitrionas deben procesar o cortar primero esta proteína de superficie viral para permitir que el virus entre en las células.
El laboratorio de Pellecchia y otros han reconocido que además de una proteasa previamente identificada llamada TMPRSS2, el nuevo coronavirus del SARS-CoV2 también podría ser procesado por una proteasa humana adicional, llamada furina, para la entrada viral.
"El uso de la proteasa furina del huésped para el procesamiento es un mecanismo común de entrada a la célula tanto de las proteínas de fusión viral como de ciertas toxinas bacterianas", dijo Pellecchia, un profesor de ciencias biomédicas, que dirigió el equipo de investigación. "El SARS-CoV2 también utiliza este mecanismo. La naturaleza del 'clivaje proteolítico' en su glicoproteína S puede determinar si este virus puede ser transmitido entre especies, por ejemplo de murciélagos o camellos a los humanos".
Una proteína de fusión combina los atributos de más de una proteína. La ruptura proteolítica se refiere al proceso de romper los enlaces peptídicos entre los aminoácidos de una proteína, lo que resulta en el corte de la proteína.
La glicoproteína S del coronavirus contiene tres sitios de división que las proteasas del huésped humano procesan. La naturaleza y secuencia exactas de estos sitios de división, y sus respectivas proteasas de procesamiento, pueden determinar el nivel de patogenicidad y si el virus puede cruzar especies.
Enfoque en los inhibidores
Pellecchia explicó que la toxina del ántrax, similar al SARS-CoV2, requiere ser procesada por la furina humana para infectar a los macrófagos, un tipo de glóbulo blanco. Utilizando la toxina del ántrax como sistema modelo, su equipo encontró que un inhibidor tanto del TMPRSS2 como de la furina en modelos celulares y animales puede suprimir eficazmente la entrada de la toxina en las células.
Un ensayo clínico con pacientes de COVID-19 recientemente comenzó a usar el inhibidor de TMPRSS2 camostat.
"Encontramos, sin embargo, que el camostat es un pobre inhibidor de la furina", dijo Pellecchia. "Nuestro estudio actual, por lo tanto, pide el desarrollo de inhibidores de la proteasa adicionales o cócteles de inhibidores que pueden dirigirse simultáneamente tanto al TMPRSS2 como a la furina y suprimir que el SARS-CoV2 entre en la célula huésped".
Pellecchia añadió que hasta ahora la presencia de un sitio de clivaje de la furina en el SARS-CoV2 se había vinculado a una mayor patogenicidad. Pero la eliminación genética de la furina en los estudios de laboratorio celular no logró detener la entrada viral, lo que sugiere que la TMPRSS2 sigue siendo la proteasa más relevante.
Sin embargo, utilizando secuencias peptídicas de la glicoproteína S del SARS-CoV2, su equipo ha demostrado que las nuevas mutaciones en esta cepa de coronavirus dieron como resultado un procesamiento eficiente y mayor de la entrada del virus por la furina y el TMPRSS2.
"En otras palabras, el SARS-CoV2, a diferencia de otras cepas menos patógenas, puede utilizar más eficientemente ambas proteasas, TMPRSS2 y furina, para iniciar la invasión de las células huésped", dijo Pellecchia. "Mientras que la TMPRSS2 es más abundante en los pulmones, la furina se expresa en otros órganos, lo que tal vez explique por qué el SARS-CoV2 es capaz de invadir y dañar múltiples órganos".
El laboratorio de Pellecchia ya ha identificado potentes y efectivos inhibidores preclínicos de la furina y ha demostrado que estos inhibidores podrían desarrollarse como potenciales terapéuticos del COVID-19, quizás en combinación con drogas como el camostat, el inhibidor del TMPRSS2.
Se busca financiación
"Estamos buscando fondos adicionales para continuar con el diseño y desarrollo de inhibidores duales que puedan atacar simultáneamente tanto al TMPRSS2 como a la furina", dijo Pellecchia. "La financiación nos permitiría explorar nuevas posibles terapias efectivas contra COVID-19 y apoyar estudios que podrían tener aplicaciones de gran alcance para prevenir posibles pandemias futuras resultantes de mutaciones activadoras similares en otras cepas virales".
Pellecchia, que ocupa la Cátedra Daniel Hays de Investigación sobre el Cáncer en la Facultad de Medicina de la UCR, se unió a la investigación de Elisa Barile, Carlo Baggio y Luca Gambini de la UCR; y Sergey A. Shiryaev y Alex Y. Strongin del Instituto de Descubrimiento Médico Sanford Burnham Prebys en La Jolla.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.