Prevención de metástasis tumorales
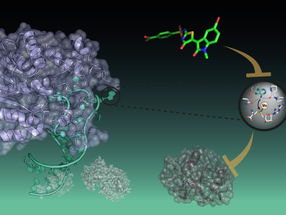
Cuando las células cancerosas se diseminan en el cuerpo, pueden desarrollarse tumores secundarios, llamados metástasis. Éstos son responsables de alrededor del 90 por ciento de las muertes en pacientes de cáncer. Una vía importante para diseminar las células cancerosas es a través del sistema linfático, que, al igual que el sistema de vasos sanguíneos, recorre todo el cuerpo y conecta los ganglios linfáticos entre sí. En la migración de los glóbulos blancos a través de este sistema, por ejemplo para coordinar la defensa contra los patógenos, una proteína especial de la membrana, el receptor de quimiocinas 7 (CCR7) juega un papel importante. Se asienta en el caparazón de las células, la membrana celular, de tal manera que puede recibir señales externas y retransmitirlas hacia el interior. En el marco de un proyecto conjunto con la empresa farmacéutica F. Hoffmann-La Roche AG (Roche), los investigadores del Instituto Paul Scherrer (PSI) han podido por primera vez descifrar la estructura del CCR7 y sentar las bases para el desarrollo de un fármaco que podría prevenir la metástasis en ciertos tipos de cáncer prevalentes, como el cáncer colorrectal.

Steffen Brünle (derecha) y Jörg Standfuss en el aparato que utilizan para separar las proteínas entre sí. Para su estudio, los investigadores modificaron las células de los insectos para producir una proteína humana. Para extraer esto de la célula, la célula fue destruida, y luego la proteína, cuya estructura los investigadores han elucidado ahora, fue separada con la ayuda de este aparato.
Paul Scherrer Institut/Markus Fischer
En las células de todos los vertebrados, hay 20 receptores de quimiocinas diferentes que pueden interactuar con más de 40 proteínas de señalización llamadas quimiocinas. Cada una de estas proteínas de señalización encaja sólo en receptores muy específicos. A su vez, si una de las proteínas de señalización se une a un receptor, desencadena procesos dentro de la célula que conducen a una respuesta celular específica a la señal.
El CCR7 es uno de los receptores que controlan el movimiento de las células dentro del cuerpo. Tan pronto como la proteína de señalización apropiada fuera de la célula se une a ella, una reacción en cadena en la célula hace que la célula se mueva en la dirección de la concentración más alta de la proteína de señalización. La célula sigue el rastro de la quimiocina como un sabueso siguiendo un olor. Por ejemplo, un flujo constante de glóbulos blancos, células importantes del sistema inmunológico del cuerpo, se dirige a los ganglios linfáticos.
Las células cancerosas también pueden aprovechar el CCR7 y usar mal el receptor celular para sus propios fines. La proteína de señalización apropiada los guía fuera del tumor y hacia el sistema linfático. Además, se propagan por el cuerpo y eventualmente forman metástasis en otros tejidos. Estos tumores hijos aumentan drásticamente el riesgo de mortalidad de los afectados.
Los agentes artificiales evitan que las células migren
Para aumentar la tasa de supervivencia de los pacientes con cáncer, es de gran interés médico suprimir el proceso de metástasis. Es por eso que los investigadores de la ISP han utilizado la cristalografía de rayos X en la Fuente de Luz Suiza (SLS) en la ISP para descifrar la estructura del receptor CCR7.
Esta estructura sirvió de base para la búsqueda, en colaboración con Roche, de los agentes activos correspondientes. "La molécula correcta puede evitar que la proteína de señalización se acople al receptor y provoque una reacción en la célula", explica Steffen Brünle, quien realizó el estudio como investigador postdoctoral en el programa PSI-FELLOW-II-3i y es uno de los primeros autores del trabajo. Descifrar la estructura del receptor fue un verdadero desafío. "Lo difícil fue producirlos, en primer lugar, de tal manera que pudiéramos examinarlos con cristalografía de rayos X", dice Jörg Standfuss, co-líder del proyecto y del grupo de investigación de Cristalografía Resuelta en el Tiempo de PSI. Para acelerar el proceso de investigación, Roche desarrolló sus propios módulos de tecnología de modificación de proteínas, los llamados chaperones de cristalización.
Con información sobre la estructura precisa del receptor, pudieron identificar una molécula adecuada que bloquea el receptor y así evita que una señal sea transmitida a la célula. "Nuestros experimentos muestran que la molécula artificial, dentro de la célula, se une al receptor. Esto evita que se inicie la reacción en cadena que conduce a la migración celular", dice Brünle.
El valor de la colaboración científica
A partir de millones de moléculas depositadas en una base de datos de Roche, y utilizando la estructura del receptor ligado al fármaco, los científicos de Roche utilizaron la simulación por ordenador para buscar agentes correctores que pudieran ser adecuados para bloquear la proteína de señalización, e identificaron cinco compuestos como posibles candidatos para el desarrollo ulterior de fármacos potenciales para el tratamiento del cáncer.
Además, uno de los agentes activos que los investigadores descubrieron en su estudio ya está siendo probado por la industria farmacéutica, en ensayos clínicos, como un fármaco potencial contra la metástasis. Anteriormente se había pensado que este agente se une a un receptor diferente y por lo tanto inhibe otra función de la célula cancerosa. Esto pone de manifiesto que los resultados de estos estudios pueden ser extraordinariamente valiosos para la investigación y el desarrollo farmacéutico.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
"Structural basis for allosteric ligand recognition in the human CC chemokine receptor 7"; K. Jaeger, S. Bruenle, T. Weinert, W. Guba, J. Muehle1, T. Miyazaki, M. Weber, A. Furrer, N. Haenggi, T. Tetaz, C. Huang, D. Mattle, J.-M. Vonach, A. Gast, A. Kuglstatter, M.G. Rudolph, P. Nogly, J. Benz, R.J.P. Dawson, J. Standfuss; Cell; 22. August 2019 (online)