Versteckter Sicherheitsschalter: Neue Erkenntnisse zu Todesrezeptoren bei Krebszellen
Ein besseres molekulares Verständnis der Rolle von sogenannten Todesrezeptoren in der Krebsentstehung, die insbesondere Bauchspeicheldrüsenkrebs besonders aggressiv und fast immer tödlich verlaufen lassen – das ist das Ziel von Wissenschaftlern am Institut für Experimentelle Tumorforschung an der Medizinischen Fakultät der Christian-Albrechts-Universität zu Kiel (CAU). Die Arbeitsgruppe unter der Leitung von Professorin Anna Trauzold und Professor Holger Kalthoff beschäftigt sich seit mehr als zehn Jahren mit diesen Todesrezeptoren, die in fast allen Körperzellen und prinzipiell auch in Krebszellen für das kontrollierte Absterben der Zelle, den programmierten Zelltod, sorgen können. Dieses Selbstmordprogramm wird typischerweise über Rezeptoren auf der Zellmembran ausgelöst. Krebszellen haben jedoch vielfältige Mechanismen entwickelt, mit denen sie dieses Programm umgehen können. Ein körpereigener Sicherheitsschalter wird so gewissermaßen ausgeschaltet und es entstehen Resistenzen gegenüber Chemotherapeutika oder Bestrahlung. Die Kieler Arbeitsgruppe konnte jüngst neue Erkenntnisse über die Mechanismen gewinnen, mit denen Todesrezeptoren in Krebszellen zu beschleunigten bösartigen Krankheitsverläufen beitragen: „Wir konnten nachweisen, warum Todesrezeptoren paradoxerweise bei vielen Krebszellen gehäuft vorkommen und wie die Umprogrammierung der Todesrezeptoren in der Zelle bewerkstelligt wird“, erklärt Trauzold die neuesten Erkenntnisse.
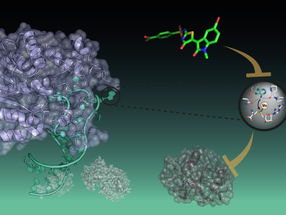
Rezeptoren für den programmierten Zelltod sind Oberflächenmoleküle auf der Membran von Krebszellen wie beispielsweise das Molekül CD95 oder die Moleküle der TRAIL-R-Gruppe. In Kooperation mit Kollegen der Klinik für Allgemeine Chirurgie und Thoraxchirurgie des Universitätsklinikums Schleswig-Holstein, Campus Kiel, konnte die Forschungsgruppe jetzt überzeugend nachweisen, dass Bauchspeicheldrüsenkrebszellen die Signale dieser Rezeptoren umprogrammieren können. Statt des erwünschten Zelltodprogramms initiieren sie dann einen alternativen zellbiologischen Mechanismus. Der Schutzschalter der Zelle wird also in seiner eigentlichen Funktion deaktiviert und sorgt stattdessen im Gegenteil für eine aggressive Ausbreitung der Krebserkrankung. „In der klinischen Krebsforschung gelten die Rezeptoren TRAIL-R1 und TRAIL-R2 eigentlich als vielversprechende Therapieansätze, weil der zugehörige Botenstoff prinzipiell Krebszellen gut abtöten kann und normale Körperzellen nicht schädigt“, sagt Kalthoff. In diesem Zusammenhang sei die Wirkung des defekten Sicherheitsschalters allerdings besonders fatal, da eine Behandlung mit TRAIL-Liganden dann eine starke gegenteilige Wirkung entfaltet und zur beschleunigten Ausbreitung des Tumors führen kann. Dazu passt die Beobachtung der Kieler Forschenden, dass Bauchspeicheldrüsenkrebszellen diesen Botenstoff häufig selbst produzieren, sich also selbst stimulieren.
Eine wichtige Rolle in dieser Umprogrammierung der Todesrezeptoren spielt die genaue Verteilung der Todesrezeptoren. Analysen der Kieler Wissenschaftlerinnen und Wissenschaftler zeigen, dass diese Moleküle oft nicht auf der Zellmembran positioniert sind, wo sie in normalerweise für die Auslösung des Zelltodes sorgen. Stattdessen befinden sie sich im Zellkern der Krebszelle und kommen dort gehäuft vor. Dies konnte die Arbeitsgruppe bereits 2014 in der anerkannten internationalen Fachzeitschrift Gastroentorology zeigen. Dort bewirken sie dann verschiedene zum Zelltodprogramm alternative Prozesse, deren Ergebnis ein verstärktes Wachstum und eine verstärkte Wanderung der Krebszellen ist. In einer aktuellen Veröffentlichung im Fachmagazin Cancer Cell im April diesen Jahres konnten die Kieler Forschenden zusammen mit der Arbeitsgruppe von Professor Henning Walczak vom University College in London nun zeigen, dass der TRAIL-Rezeptor bei seinen unerwünschten Aktivitäten Unterstützung von einem seit langem bekannten Krebsgen bekommt: Bei vielen bösartigen Tumoren und in fast allen Bauspeicheldrüsenkrebszellen liegt eine Mutation des sogenannten KRAS-Gens vor. Es kooperiert mit dem Todesrezeptor so, dass dieser sein Programm von der Einleitung des Zelltodes hin zu Wachstum und Ausbreitung von Krebszellen abändert – auch wenn sich der Todesrezeptor an der „richtigen“ Stelle auf der Zellmembran befindet.
„Unsere Ergebnisse bedeuten, dass auch bei konventionellen Krebsbehandlungen mit Chemotherapeutika oder Bestrahlung künftig die Rolle der Todesrezeptoren und ihr Einfluss auf die Ausbreitung von Krebszellen stärker berücksichtigt werden muss“, sagt Trauzold. Gleichzeitig zeigen die Untersuchungen der Kieler Forschungsgruppe auch neue Ansätze auf, wie die Therapieresistenz von Krebszellen möglicherweise überwunden werden kann. Versuche mit Zellkulturen zeigen, dass ein sehr stark gehäuftes Vorkommen von Todesrezeptoren auf der Zelloberfläche dafür sorgt, dass auch Bauspeicheldrüsenkrebszellen absterben. Dringenden Forschungsbedarf sehen Trauzold und Kalthoff demnach in der Frage, wie die Rezeptoren zurück an ihre Position an der Zelloberfläche von Krebszellen gebracht werden können, um dort effektiv, zum Beispiel durch Hemmung der unerwünschten Signalwege, aktiviert werden zu können.
Originalveröffentlichung
Verena Haselmann et al.; Gastroenterology: Nuclear Death Receptor TRAIL-R2 Inhibits Maturation of Let-7 and Promotes Proliferation of Pancreatic and Other Tumor Cells
Silvia von Karstedt et al.; Cancer Cell: Autonomous TRAIL-R Signaling Promotes KRAS-Driven Cancer Progression, Invasion, and Metastasis