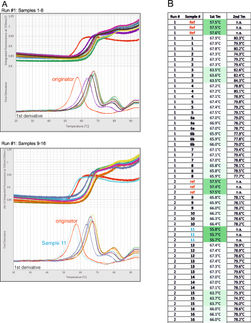
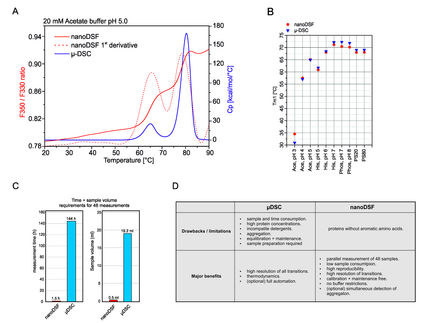
Analyse von Enzymstabilität ohne Limitierung der Pufferzusammensetzung
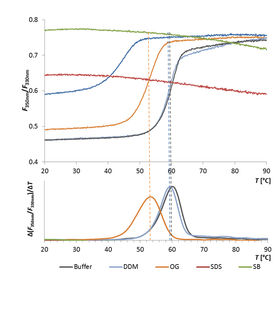
Thermische Entfaltung einer Esterase in verschiedenen Detergenzien
nanoDSF ist eine revolutionäre Methode, um die Thermostabilität von Proteinen zu bestimmen. Dabei werden Änderungen der intrinsischen Fluoreszenz gemessen und analysiert.
In dieser Vergleichsstudie wurde mit Hilfe des Prometheus NT.48 die thermische Stabilität der Membran-Esterase PA2949 aus Pseudomonas aeruginosa in verschiedenen Detergenzien getestet.
Die Art des Detergenz zeigte dabei einen großen Einfluss auf die thermische Stabilität des Enzyms, die wiederum stark mit der Enzymaktivität im jeweiligen Detergenz korrelierte.
Der Prometheus NT.48 findet also schnell optimale Bedingungen für die Aufreinigung von Enzymen und erlaubt eine Evaluation der Enzymaktivität basierend auf der strukturellen Stabilität in Detergenzien.
White-Paper-Einordnung
Anwendungen
Jetzt White Paper herunterladen
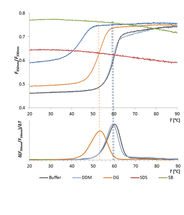
Analyse von Enzymstabilität ohne Limitierung der Pufferzusammensetzung
Thermische Entfaltung einer Esterase in verschiedenen Detergenzien