Zentraler Schalter
3D Faltung der DNA gibt bei der Bildung von Herzmuskelzellen wichtige epigenetische Mechanismen vor
Während sich eine Herzstammzelle zu einer Herzmuskelzelle differenziert, organisiert sich die dreidimensionale Faltung der DNA neu – und gibt damit epigenetische Muster vor, die für die Differenzierung ebenfalls eine wichtige Rolle spielen. Zu diesem Ergebnis kommt ein Team um Stephan Nothjunge und Privatdozent Dr. Ralf Gilsbach, die beide an der Universität Freiburg an der Professur für Pharmakologie und Toxikologie in der Abteilung von Prof. Dr. Lutz Hein forschen. Die Befunde legen nahe, dass die räumliche Organisation des Genoms ein wichtiger Schalter für die Definierung von Zelltypen ist und somit auch einen vielversprechenden Ansatzpunkt für die Reprogrammierung von Zelltypen darstellt.
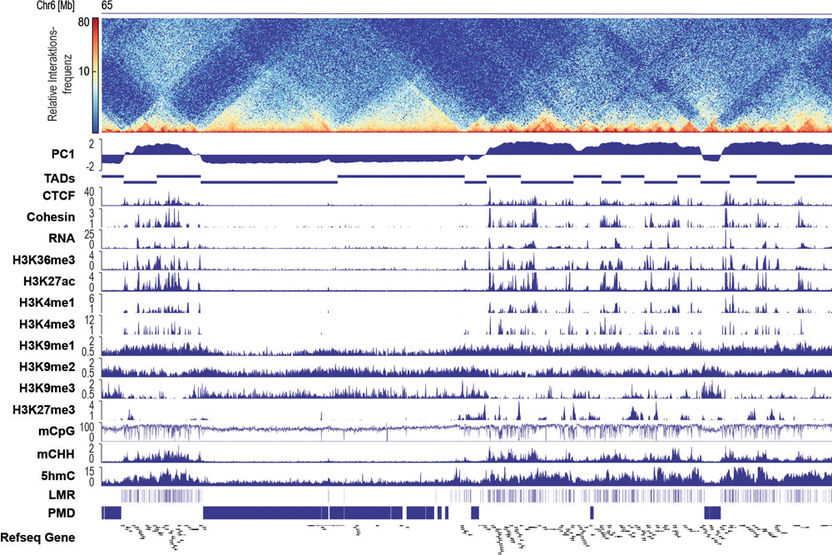
Zusammenspiel der dreidimensionalen Faltung der DNA mit epigenetischen Markierungen in Herzmuskelzellen.
Experimentelle und Klinische Pharmakologie und Toxikologie, Universität Freiburg
Das Genom speichert die Information für die Entstehung eines Organismus. Jede Zelle trägt diese Information dichtgepackt auf einem zwei Meter langen DNA-Strang im Zellkern. Epigenetische Mechanismen steuern die Zugänglichkeit der genomischen Information. Da jeder Zelltyp des menschlichen Körpers den Zugriff auf jeweils andere Bereiche des Genoms benötigt, ist das Epigenom entscheidend für die Festlegung der zellulären Identität. Schon bekannt ist, dass verschiedene epigenetische Mechanismen mit der Differenzierung von Zelltypen assoziiert sind. Unverzichtbar ist insbesondere die Methylierung der DNA, bei der Methylgruppen an bestimmte Bausteine des DNA-Doppelstrangs angehängt werden. Aktuelle Studien zeigen außerdem auf, dass Differenzierungsvorgänge mit einer Reorganisation der dreidimensionalen Faltung der DNA einhergehen. Bisher war jedoch unklar, was während der Differenzierung von Herzmuskelzellen zuerst kommt: die Reorganisation der Faltung der DNA im Zellkern oder die Methylierung der DNA – und ob diese Mechanismen voneinander abhängen.
Um diese Frage zu beantworten, verwendete das Team um die Freiburger Pharmakologen moderne Sequenzierungsmethoden. Diese ermöglichten es, die dreidimensionale Genomorganisation sowie epigenetische Mechanismen während der Differenzierung von Herzmuskelzellen genomweit zu kartieren. Dafür etablierten die Forscherinnen und Forscher Methoden zur Isolation von Herzmuskelzellen verschiedener Entwicklungsstadien aus intakten Herzen. Erst diese Zelltyp-spezifische Analyse zeigte, dass es ein enges Zusammenspiel zwischen epigenetischen Mechanismen und der räumlichen Faltung der DNA im Zellkern von Herzmuskelzellen gibt. Der Vergleich verschiedener Entwicklungsstadien ergab, dass die Art der räumlichen Faltung der DNA vorgibt, welche Methylierungsmuster sich ausbilden und welche Gene aktiviert werden. Dass die räumliche Anordnung der DNA dagegen nicht abhängig von der DNA-Methylierung ist, wiesen die Forscher unter anderem an Zellen nach, die über keine DNA-Methylierung verfügen. Die dreidimensionale Genomorganisation ist somit ein zentraler Schalter für die Festlegung der zellulären Identität. Zukünftig möchten die Freiburger Forscher diesen Schalter nutzen, um zelluläre Funktionen zu steuern.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Stephan Nothjunge, Thomas G. Nührenberg, Björn A. Grüning, Stefanie A. Doppler, Sebastian Preissl, Martin Schwaderer, Carolin Rommel, Markus Krane, Lutz Hein & Ralf Gilsbach; "DNA methylation signatures follow preformed chromatin compartments in cardiac myocytes"; Nature Comm.; 2017
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.