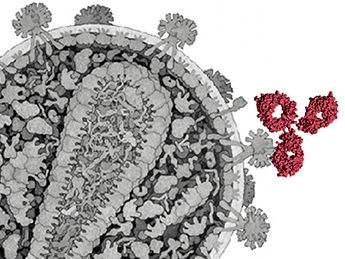
Das Ebola-Virus schützt sein Erbgut mit einer Umarmung
Erstmals Proteinhülle des Genoms intakter Viren in hoher Auflösung rekonstruiert
Geborgen im Arm des Killers: Ein Forschungsteam aus Heidelberg, Marburg und Kyoto hat die Struktur der Genomhülle aufgeklärt, mit der das Ebola-Virus seine Erbinformation schützt. Die Wissenschaftler kombinierten Kristallstrukturstudien und Elektronenmikroskopie, um erstmals die Proteinhülle des Genoms intakter Viren in hoher Auflösung zu rekonstruieren.
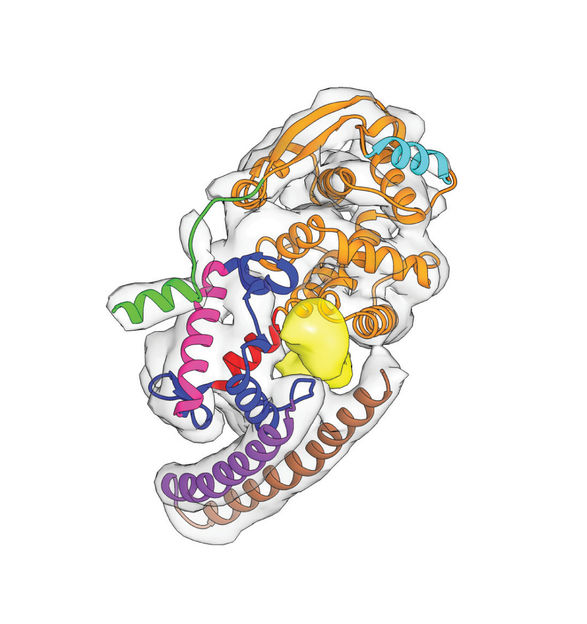
Erbgut im Klammergriff: Ein Ausleger des Nukleoprotein-Knäuels (unten) umfasst die kostbare RNA (gelb), die das Genom des Ebola-Virus trägt.
John Briggs
Viren wie die Erreger des Ebola- und des Marburgfiebers enthalten ein Genom in Form eines RNA-Moleküls. Da die befallenen Wirtszellen Enzyme enthalten, die RNA abbauen, schützen die Viren ihr Erbgut durch eine Hülle, das so genannte Nukleokapsid. „Bisher gab es keine Rekonstruktion, die das Nukleokapsid intakter Viren dieses Typs in hoher Auflösung zeigt“, erklärt der Marburger Virologe Professor Dr. Stephan Becker, dessen Arbeitsgruppe an der Studie beteiligt ist. Die Untersuchungsergebnisse erleichtern es, zu verstehen, wie sich das Virus während einer Infektion vervielfältigt.
Das Team bestimmte die Struktur des Nukleokapsids von Ebolaviren, indem es Kristallstrukturanalysen mit elektronenmikroskopischen Untersuchungen kombinierte. Die ermittelten Daten zeigen, wie die Proteine aussehen, aus denen das Nukleokapsid besteht, und wie die eizelnen Nukleoproteine zum Kapsid zusammengefügt sind.
Dabei blieben Überraschungen nicht aus. „Bisher dachte man, die RNA werde dadurch eingekapselt, dass sich zwei Ausbuchtungen der Nukleoproteine über einer Rinne schließen, in der sich die RNA befindet“, erläutert Becker. Die Gruppe stellte fest, dass dies nicht zutrifft. Die Forscher fanden stattdessen eine Art Klammer, die das RNA-Molekül festhält: Das wendelförmige Endstück des Nukleoproteins bildet einen Ausleger, der die RNA umfasst und festklemmt.
Die verlängerte Wendel trägt außerdem dazu bei, dass sich die Nukleoproteine zusammenlagern. „Wir schlagen ein Modell vor, in dem die Wendel sich von einer kurzen, offenen, gelösten Form zu einer langen, geschlossenen, zusammengelagerten Form transformiert“, schreiben die Autorinnen und Autoren. „Dieser Übergang bildet eine mechanistische Verbindung zwischen der Zusammenlagerung von Nukleoproteinen und der Verkapselung der RNA.“
Professor Dr. Stephan Becker leitet das Institut für Virologie der Philipps-Universität. Beckers Arbeitsgruppe gewann Viren und Virusproteine für die Untersuchungen, die größtenteils am Europäischen Labor für Molekularbiologie in Heidelberg durchgeführt wurden. Das Marburger Institut verfügt über eines der Labore mit dem höchsten Sicherheitsstandard in Europa, das für Studien an lebensgefährlichen Erregern wie Ebola- und Marburgvirus die besten Voraussetzungen bietet. Die Studie wurde unter anderem durch den Marburger Sonderforschungsbereich 1021 der Deutschen Forschungsgemeinschaft sowie durch das Deutsche Zentrum für Infektionsforschung (DZIF) finanziell gefördert.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.