Molekül-Schere funktioniert auch in abgespeckter Form
Bakterien-Enzym offenbart evolutionäre Entwicklung
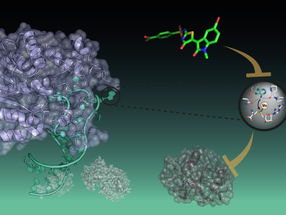
Ein missing link der molekularen Evolution gibt seine Geheimnisse preis: Eine Molekül-Schere, die Zellen brauchen, um Proteine nach Plan zu produzieren, liegt bei dem hitzeliebenden Bakterium Aquifex aeolicus in einer Minimalversion vor, die in dieser Form bisher unbekannt war. Das berichtet ein Forschungsteam um den Biochemiker Professor Dr. Roland Hartmann von der Philipps-Universität.
Das Enzym „RNase P“ schneidet ein zentrales Molekül der zellulären Eiweißsynthese, nämlich Transfer-RNA. RNase P besteht bei den meisten Bakterien aus zwei verschiedenartigen Molekültypen. „Das eigentliche Enzym ist eine Nukleinsäure (RNA), die zusätzlich von einem Protein unterstützt wird“, erläutert Studienleiter Roland Hartmann, der Pharmazeutische Chemie an der Philipps-Universität lehrt. Dieses Enzym sei jedoch bei Aquifex aeolicus verloren gegangen; „das blieb lange rätselhaft, denn es übt eine lebensnotwendige Funktion aus.“
Hartmann und sein Team fanden außerdem heraus, dass beide Versionen der Molekül-Schere – mit oder ohne RNA – nebeneinander in ein und derselben Zelle vorkommen können, jedoch fast ausschließlich bei Vertretern der Archaea; dabei handelt es sich um die dritte große Gruppe von Lebewesen neben Bakterien und Eukaryoten, den Organismen mit echtem Zellkern.
„Offenbar besitzen die beiden Enzymtypen bei den Archaea sich ergänzende Funktionen“, schlussfolgert Hartmann. „Der Ahne des Bakteriums Aquifex hingegen hat das Gen für das RNA-freie Enzym wohl irgendwann in der Evolution von einem Archaeon erhalten. Es wurde dann wahrscheinlich für die Funktion als alleinige RNase P optimiert.“
Das Team entdeckte auch einige wenige Bakterien, die ebenfalls beide Versionen des Enzyms besitzen. „Diese könnten evolutionäre Übergangszustände repräsentieren, bei denen das neue Enzym im Begriff ist, das alte zu verdrängen“, legt Hartmann dar.
Wie die Wissenschaftler feststellten, ist das Minimalenzym in der Lage, die übliche RNA-haltige Form zu ersetzen: Sowohl das Darmbakterium Escherichia coli, das liebste Modellsystem der Lebenswissenschaften, als auch die Bierhefe Saccharomyces cervesiae wachsen auch ohne ihre herkömmliche RNase P, sofern man die neuentdeckte Form des Enzyms in sie einschleust.
Originalveröffentlichung
Astrid Nickel & al.; "Minimal and RNA-free RNase P in Aquifex aeolicus"; PNAS; 2017
Meistgelesene News
Originalveröffentlichung
Astrid Nickel & al.; "Minimal and RNA-free RNase P in Aquifex aeolicus"; PNAS; 2017
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.