Evolution eines bakteriellen Enzyms in Grünalgen
Grünalgen produzieren Wasserstoff, einen potenziellen Energieträger der Zukunft. Aber wie sind sie eigentlich an die Enzyme dafür gekommen?

Im Labor haben Vera Engelbrecht und Thomas Happe einen Einblick in die Evolution der Grünalgen erhascht.
© RUB, Marquard
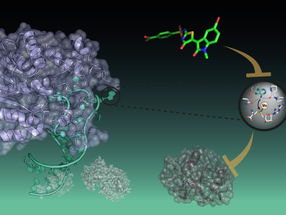
Ein neues Puzzlestück in der Evolution von Grünalgen haben Forscher der Ruhr-Universität Bochum mit Kollegen vom Max-Planck-Institut in Mülheim an der Ruhr entdeckt. Sie untersuchten das wasserstoffproduzierende Enzym einer stammesgeschichtlich alten Alge. Es hatte ganz andere Eigenschaften als vergleichbare Enzyme in moderneren Algen. Das Team um Vera Engelbrecht und Prof. Dr. Thomas Happe von der Bochumer Arbeitsgruppe Photobiotechnologie beschreibt die Ergebnisse in der Zeitschrift „Biochimica et Biophysica Acta“.
Andocken an die Fotosynthese
Wasserstoffproduzierende Enzyme, sogenannte Hydrogenasen, kommen ursprünglich in vielen Bakterien vor. Aber auch Grünalgen besitzen solche Enzyme, mit denen sie lichtgetrieben Wasserstoff herstellen. „Über die Herkunft dieser Enzyme in Algen tappte man lange im Dunkeln“, sagt Vera Engelbrecht. „Jetzt haben wir ein bislang fehlendes Bindeglied in der Evolutionsgeschichte von Hydrogenasen untersucht.“
Algen, die evolutionär gesehen noch relativ jung sind, haben spezialisierte Hydrogenasen, die deutliche Unterschiede zu den ursprünglichen Bakterienvarianten aufweisen. Sie sind kleiner und haben eine besondere Oberfläche, mit der sie sich an die Fotosynthesemaschinerie der Zelle andocken. Dazu binden sie an das Elektronenüberträger-Molekül Ferredoxin. So können sie mittels Lichtenergie Wasserstoff produzieren.
Anders als bei jungen Algen
Auch die stammesgeschichtlich alte Alge Chlorella variabilis kann lichtgetrieben Wasserstoff erzeugen. Die Bochumer und Mülheimer Forscher isolierten und charakterisierten die Chlorella-Hydrogenase. Anders als bei jungen Algen ist sie dem urtümlichen Bakterienenzym aber recht ähnlich und kann nicht an den Elektronenüberträger Ferredoxin binden.
„Das Ergebnis hat uns überrascht“, erklärt Thomas Happe. „In Chlorella scheint noch ein urtümlicher Stoffwechselweg vorzuliegen, der sich in den stammesgeschichtlich jüngeren Algen völlig verändert hat.“ Warum die modernen Algen die spezialisierte Hydrogenase entwickelt haben, um sich über Ferredoxin an die Fotosynthese zu koppeln, sei noch ungeklärt. „Wir versuchen momentan, die genaue Stoffwechselanbindung der Chlorella-Hydrogenase aufzudecken und bislang noch unbekannte fotosynthetische Proteinkomplexe in dem Organismus zu finden“, sagt Happe.
Originalveröffentlichung
Vera Engelbrecht, Patricia Rodríguez-Maciá, Julian Esselborn, Anne Sawyer, Anja Hemschemeier, Olaf Rüdiger, Wolfgang Lubitz, Martin Winkler, Thomas Happe: "The structurally unique photosynthetic Chlorella variabilis NC64A hydrogenase does not interact with plant-type ferredoxins"; Biochimica et Biophysica Acta; 2017
Meistgelesene News
Originalveröffentlichung
Vera Engelbrecht, Patricia Rodríguez-Maciá, Julian Esselborn, Anne Sawyer, Anja Hemschemeier, Olaf Rüdiger, Wolfgang Lubitz, Martin Winkler, Thomas Happe: "The structurally unique photosynthetic Chlorella variabilis NC64A hydrogenase does not interact with plant-type ferredoxins"; Biochimica et Biophysica Acta; 2017
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.