Wie Cohesin die Erbsubstanz in Falten legt
Forscher zeigen, wie DNA-Schleifen zur Genregulation gebildet werden
Um DNA platzsparend zu verpacken, aber auch um entfernte Bereiche einander anzunähern, wird die Erbsubstanz im Zellkern zu Schleifen gefaltet. Wissenschaftler am Wiener Forschungsinstitut für Molekulare Pathologie (IMP) klären einen beteiligten Mechanismus.
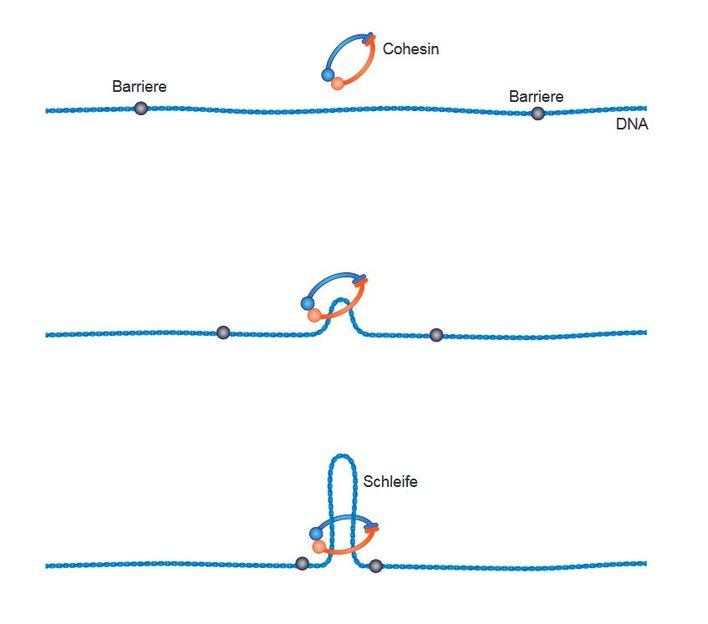
Legen Schematische Darstellung des “loop-extrusion” Mechanismus.
Copyright: IMP
Vor 20 Jahren wurde am IMP ein Molekül entdeckt, dessen Form auf erstaunliche Weise mit seiner Funktion korrespondiert. Der ringförmige Proteinkomplex, der bei der Zellteilung die verdoppelten Chromosomen bis zu ihrer endgültigen Trennung umklammert, erhielt daher folgerichtig den Namen Cohesin.
Neben seiner entscheidenden Rolle bei der Zellteilung entdeckten die Forscher am IMP und anderswo in den folgenden Jahren noch weitere wichtige Aufgaben des Cohesins. So hilft der Komplex, die insgesamt zwei Meter langen DNA-Fäden, die in jedem Zellkern enthalten sind, auf ein winziges Maß zu komprimieren; unter anderem dadurch, dass die DNA in Schleifen gelegt wird. „Wir vermuten, dass auch dabei der Cohesin-Ring die DNA wie eine Spange umfasst“, beschreibt IMP-Direktor Jan-Michael Peters die gängige Hypothese.
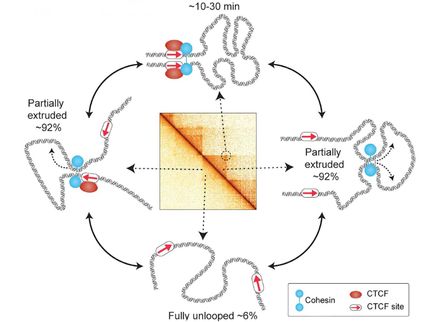
Die Schleifenbildung erfolgt nicht willkürlich. Form und Position der Schleifen haben entscheidenden Einfluss auf die Genregulation, indem sie bestimmte DNA-Regionen einander annähern. „Lange war es ein Rätsel, wie regulatorische Elemente - die Enhancer - weit entferne Gene aktivieren können. Die Lösung liegt vermutlich im präzise gesteuerten Zurückfalten der DNA, wodurch die Enhancer mit den richtigen Genen in Kontakt kommen“, so Peters.
Mit großer Wahrscheinlichkeit ist auch dafür das Cohesin notwendig. Peters und sein Team hatten bereits gezeigt, dass die Komplexe genau dort angereichert sind, wo die DNA-Stränge zu Schleifen aufgefaltet sind.
Seit kurzem wird spekuliert, dass diese Schleifenbildung durch einen sogenannten „loop extrusion“-Mechanismus erfolgt. Nach dieser Hypothese umschließt das Cohesin den DNA-Strang zunächst an einer beliebigen Stelle. Anschließend wird die DNA durch den Cohesin-Ring „gepumpt“, bis eine molekulare Barriere die Bewegung stoppt. Dieses Element, das wie ein Knoten im Seil wirkt, ist ein DNA-bindendes Protein mit der Bezeichnung CTCF. Auf diese Art und Weise können weit voneinander entfernte Abschnitte im Genom gezielt in direkten Kontakt gebracht werden, um so ihre Funktionen bei der Genregulation auszuüben.
In ihrer aktuellen Arbeit präsentieren die IMP-Forscher nun Hinweise, die für die Existenz eines solchen Mechanismus sprechen. Georg Busslinger, Doktorand im Team von Jan-Michael Peters, konnte in Mauszellen nachweisen, dass sich die Cohesin-Komplexe tatsächlich über weite Strecken entlang des DNA-Strangs bewegen. Die Transkription, also das Ablesen der DNA-Information, wirkt dabei teilweise als Motor.
„Wir haben die Tür zu einem Phänomen aufgestoßen, mit dem sich noch viele zukünftige Arbeiten beschäftigen werden“, kommentiert Jan-Michael Peters die Publikation. Die Wirkmechanismen von Cohesin zu verstehen sei auch deshalb so wichtig, weil zahlreiche Erkrankungen bis hin zu Krebs mit Fehlfunktionen des Cohesins assoziiert sind.