Kenne deinen Feind
Ein Arsenal zur Bekämpfung antibiotikaresistenter Bakterien
Um deine Feinde zu bekämpfen, hilft es, ihre Schwächen zu kennen. Und je spezifischer dein Wissen, desto leichter ist es, ihre Verteidigung zu untergraben. Wenn dein Feind zum Beispiel sicher hinter einer riesigen Mauer sitzt, ist es wertvoll zu wissen, wie dein Feind sie gebaut hat, welche Materialien er verwendet hat und welche Risse du ausnutzen kannst.
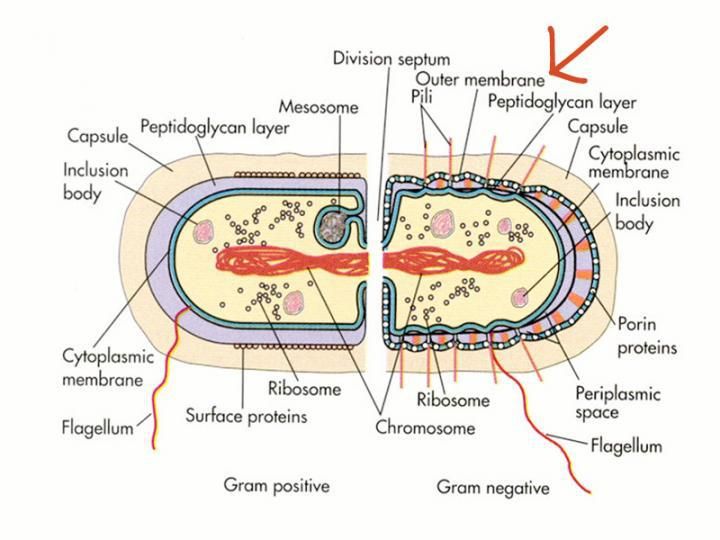
Die dicke Außenmembran der gramnegativen Bakterien verhindert das Eindringen von toxischen Molekülen, einschließlich Antibiotika.
Microbiology Concepts (http://microbiologyconcepts.blogspot.com/2017/03/bacteria.html)
Wir teilen einen globalen Feind: antibiotikaresistente Bakterien. Nach Angaben des Centers for Disease Control and Prevention (CDC) könnten "ohne dringende Maßnahmen viele moderne Medikamente obsolet werden, was häufige Infektionen in tödliche Gefahren verwandelt". Bestimmte Bakterien, so genannte gramnegative Bakterien, haben eine starke äußere Abwehr, die sie vor Giftstoffen schützt, einschließlich Antibiotika.
Um dieser wachsenden Krise zu begegnen, dokumentieren die Forscher des Kahne-Labors akribisch, wie unsere Feinde funktionieren. In den letzten Jahren identifizierten sie eine Reihe von bisher unbekannten molekularen Maschinen und Prozessen, die die hartnäckige Barriere der Bakterien, die so genannte Außenmembran, bilden. Mit diesen Entdeckungen beginnen sie, ihre Schwächen zu entschlüsseln.
Jetzt beschreiben Professor Daniel Kahne zusammen mit der Postdoc-Forscherin Ran Xie und der Doktorandin Rebecca J. Taylor ihre neuesten Erkenntnisse. Gramnegative Bakterien bauen ihre Außenmembran auf, schreiben sie, mit einem kräftigen Glykolipid namens Lipopolysaccharid (LPS). Wenn wir also verhindern könnten, dass LPS die äußere Membran erreicht, könnte ihre Verteidigung schwächer werden.
"Um die Faktoren zu verstehen, die den LPS-Transport beeinflussen, haben wir eine quantitative Methode zur Überwachung der Transportraten entwickelt", berichten die Autoren. Zuvor entwarf das Team ein System, um zu verstehen, wie der LPS-Transport abläuft. Zuletzt verwendeten sie ein fluoreszierendes Material, das an LPS bindet, um zu messen, wie viel und wie schnell es sich in der äußeren Membran ansammelt. Darüber hinaus hat das Team mit seinem fluoreszenzbasierten Test herausgefunden, welche molekularen Komponenten für den LPS-Transport von Bedeutung sind. Wenn die Bakterien zum Beispiel beim Aufbau ihrer Barriere auf eine Maschine angewiesen sind, könnten die Forscher untersuchen, wie man die Maschine und damit die Verteidigung demontiert.
Mit ihrem neuartigen fluoreszenzbasierten Tool entdeckte das Team wichtige neue Details zum LPS-Transport. Die ATP-Hydrolyse - der Prozess, bei dem die Zelle Energie produziert - ist in der Tat integraler Bestandteil des LPS-Transports. Wenn der Transport stoppt, stoppt die ATP-Hydrolyse. Darüber hinaus stoppt die Zelle, selbst wenn sie LPS in Reserve und Energie zur Verfügung hat, den Transport. Das Team stellte fest, dass das translocon - die Maschine, die den LPS über die Membranen der Zelle trägt - die Bewegung steuert. "Unter Verwendung von Mutanten der Transportmaschine stellen wir fest, dass die endgültige Menge an LPS, die in die Membran abgegeben wird, von der Affinität des Translokons der äußeren Membran für LPS abhängt."
Natürlich ist noch mehr Forschung erforderlich, um zu verstehen, wie die molekularen Maschinen und Mechanismen bei gramnegativen Bakterien funktionieren (und nicht funktionieren). Aber die Forschungsarbeit des Kahne Lab könnte eines Tages zu neuen Therapien führen, um Antibiotikaresistenzen zu bekämpfen und Leben zu retten, weltweit.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.