Gene in der Zange: Neue Methode zur Untersuchung von Biomolekülen
Eine interdisziplinäre Forschergruppe der Universitäten Regensburg, Ludwig-Maximilians-Universität (LMU) München und TU Braunschweig hat eine neuartige Methode entwickelt, mit der sich Biomoleküle einfach und effizient auf ihre mechanischen Eigenschaften untersuchen lassen.

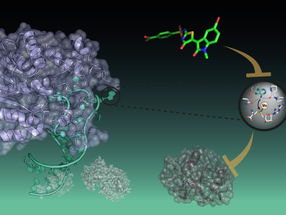
Nanoklammer aus DNA-Strängen.
Christoph Hohmann, Nanosystems Initiative Munich
Für Biologen zählen zu den wichtigsten Fragen, wie Proteine und Gene in menschlichen Zellen arbeiten, wie sie ihre Aufgaben erledigen und mit etwaigen Störungen umgehen. Von großer Bedeutung ist dabei, wie die Biomoleküle auf winzigste Krafteinwirkungen reagieren. Wissenschaftler der Universitäten Regensburg, München und Braunschweig haben nun eine neue Methode entwickelt, mit deren Hilfe man gezielt konstante Kräfte auf ein einzelnes, nur wenige Nanometer großes Molekül ausüben und gleichzeitig dessen Reaktion auf die angelegte Kraft beobachten kann. So lässt sich testen, ob ein Protein oder Gen seine Aufgabe noch richtig ausführt, wenn kleinste Kräfte im Inneren einer Zelle an der Struktur zerren. Für die Untersuchung mit der neuen Kraftspektroskopie-Methode, die nanoskopische Kraftmesser einsetzt, benötigt man keine makroskopischen Werkzeuge und kann zudem eine große Zahl Moleküle parallel untersuchen, ein enormer Zeitgewinn.
Mit dem neuen Ansatz umgehen die Forscher zwei fundamentale Einschränkungen bisheriger Methoden in der Kraftspektroskopie. Sowohl beim Rasterkraftmikroskop wie auch bei den sogenannten optischen und magnetischen Pinzetten haben die untersuchten Moleküle immer eine direkte Verbindung zur makroskopischen Welt. Im Grunde muss man dabei jeweils die Position eines mindestens Mikrometer großen Objekts (Kugel oder Metallspitze) genau kontrollieren und übt dann Kräfte auf Moleküle aus, die an diesem Objekt verankert sind. Das ist technisch extrem aufwändig und verursacht zudem oft fehlerbehaftete Signale. Zudem lässt sich damit immer nur ein Molekül nach dem anderen untersuchen. Von diesen Zwängen ist die neue Methode befreit. „Unsere Strukturen arbeiten völlig autonom“, erklären die Wissenschaftler der Forschergruppe. „Und wir können damit unzählige Moleküle gleichzeitig untersuchen.“
Die Wissenschaftler erstellen mithilfe der DNA-Origami-Technik zunächst aus vielen künstlichen DNA-Strängen gezielt nanometergroße, molekulare Klammern, die so konstruiert sind, dass sie selbständig Kräfte ausüben können. In ihre speziell designten DNA-Klammern spannen sie einen in der Mitte mit einer speziellen Sequenz ausgestatteten Einzelstrang ein, an den wiederum das zu untersuchende Molekül anbindet. Kraft können sie ausüben, indem sie den in der Klammer befestigten Einzelstrang gezielt um einzelne Basen verkürzen. Damit lassen sich gezielt unvorstellbar kleine Kräfte zwischen 0 und 15 Pico-Newton ausüben, das sind Billionstel Newton. Für die Forscher ist das ein ideales Untersuchungsinstrument, denn im Zellinneren wirken genau Kräfte in dieser Größenordnung auf die Proteine oder DNA ein. Die Messdaten lesen die Forscher sehr elegant über den Energieaustausch zweier eingebauter Fluoreszenzfarbstoffe aus. Da nun beim sogenannten FRET (Förster-Resonanz-Energie-Transfer) die übertragene Energie sehr stark vom Abstand der Farbstoffe abhängig ist, kann das System wie ein Lineal auf der Nanometerskala winzigste Verschiebungen im Molekül erkennen.
Die Universität Regensburg ist durch Prof. Dina Grohmann, Professur für Mikrobiologie, an der Entwicklung und Anwendung dieser Methode beteiligt. In Zusammenarbeit mit der Regensburger Wissenschaftlerin demonstrierte das Forscherteam die Möglichkeiten der neuen Kraftspektroskopie-Methode am Beispiel des sogenannten TATA-Binding-Proteins, eines wichtigen Faktors in der Genregulation. Die Forscher fanden heraus, dass dieses Protein nicht mehr effizient arbeiten kann, wenn die DNA-Zielsequenz mit mehr als sechs Pico-Newton gespannt wird. Noch steht die neue Technologie am Anfang. Da die DNA-Klammern winzig sind und autonom arbeiten können, wäre es in Zukunft sogar denkbar, sie auch in einer lebenden Zelle einzusetzen und dort die molekularen Vorgänge live zu untersuchen.