Atomare Strukturen von Proteinen aufgeklärt
Biophysiker Adam Lange ausgezeichnet
Er hat Methoden entwickelt, um die komplexen Architekturen von Proteinen mittels Festkörper-NMR in atomarer Auflösung sichtbar zu machen. Für diese bahnbrechende Aufklärungsarbeit ist Prof. Adam Lange vom Leibniz-Institut für Molekulare Pharmakologie Berlin (FMP) jetzt in Kyoto mit der ICMRBS Founders’ Medal ausgezeichnet worden.
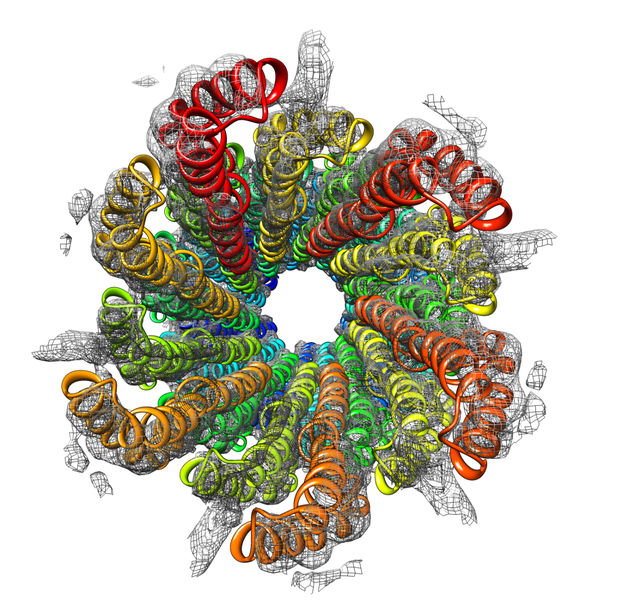
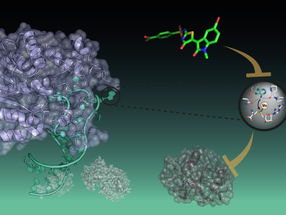
Gefährlicher Stachel von Bakterien: Die Struktur der bakteriellen Injektionsnadeln des sogenannte Typ III-Sekretionssystems in atomarer Auflösung wurde von Adam Langes Team aufgeklärt.
FMP

Prof. Adam Lange vom Leibniz-Institut für Molekulare Pharmakologie Berlin (FMP).
FMP
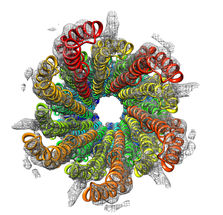

Lange und seiner Arbeitsgruppe war es gelungen, Strukturen von bakteriellen Proteinen zu bestimmen, die bei der Infektion menschlicher Wirtszellen eine entscheidende Rolle spielen. Diese Strukturen könnten einen Ansatzpunkt für die Entwicklung neuer dringend benötigter Anti-Infektiva darstellen.
Je genauer wir Krankheitserreger kennen, desto gezielter können wir sie bekämpfen. Das sagt Prof. Adam Lange vom Leibniz-Institut für Molekulare Pharmakologie Berlin (FMP) mit Blick auf seine Arbeit der letzten fünf bis zehn Jahre. Lange und seine Abteilung für Molekulare Biophysik haben neue Festkörper-NMR-Methoden (Kernspinresonanzspektroskopie) zur atomaren Strukturaufklärung von Proteinen entwickelt. Damit konnten die Forscher erstmals Strukturen von Proteinen bestimmen, die an verschiedenen Infektionsprozessen beteiligt sind bestimmen und dadurch zu einem molekularen Verständnis der bakteriellen Infektion beitragen.
Für seine neu entwickelten und auf bakterielle Proteine angewandten Methoden ist Adam Lange auf der International Conference of Magnetic Resonance in Biological Systems (ICMRBS), mit der Founder’s Medal ausgezeichnet worden. Der mit 3.000 US-Dollar dotierte Preis ist eine der wichtigsten Auszeichnungen auf dem Gebiet der NMR-Spektroskopie und wurde dem 39-jährigen Biophysiker am 23. August im Rahmen des sechstägigen Kongresses verliehen. „Die Auszeichnung würdigt Ihre wichtigen Beiträge zur Entwicklung und Anwendung von Festkörper-NMR auf biologische Systeme“, erklärte die Vorsitzende der Auswahlkommission, Prof. Mei Hong vom Massachusetts Institute of Technology (MIT). Die Arbeit habe dazu beigetragen, auch Strukturen zu untersuchen, die bisher nicht zugänglich waren. Lange erklärte unterdessen, er nehme die Auszeichnung stellvertretend für sein Team entgegen. „Dieser Preis ist der Verdienst für jahrelange konstruktive Teamarbeit“, sagte er in Kyoto.
Mit der Auszeichnung wird nicht eine einzelne Arbeit gewürdigt, sondern die systematische Methodenentwicklung über die vergangenen Jahre. Dabei hat die NMR-basierte Sichtbarmachung von Proteinstrukturen bereits zu spektakulären Einzelentdeckungen geführt: Lange und sein Team konnten zum Bespiel erstmals die Struktur der bakteriellen Injektionsnadeln des sogenannte Typ III-Sekretionssystems in atomarer Auflösung aufklären. Bei den Nadeln handelt es sich um jene Angriffswerkzeuge, die Bakterien wie Salmonellen oder der EHEC-Erreger nutzen, um molekulare Wirkstoffe in ihre Wirtszellen zu spritzen. Ein weiterer Meilenstein war die Aufklärung der atomaren Struktur von Bactofilin – einem wichtigen Element des bakteriellen Zytoskeletts, das erst vor kurzem entdeckt wurde. Bactofilin verleiht beispielsweise Helicobacter-Bakterien die Schraubenform, die es ihnen erlaubt, sich in die Magenschleimhaut zu bohren und dort Entzündungen und Geschwüre auszulösen.
„Wir betreiben hier Grundlagenforschung“, sagt Lange, „aber vor dem Hintergrund der wachsenden Zahl von Antibiotikaresistenzen sind wir angetrieben von der Idee, neue Ansatzpunkte für die Behandlung von Infektionen zu finden, etwa neuartige Anti-Infektiva, die spezifischer und zu einem viel früheren Zeitpunkt wirken als traditionelle Antibiotika.“
Adam Lange wechselte 2014 vom Max-Planck-Institut für Biophysikalische Chemie in Göttingen an das Leibniz-Institut für Molekulare Pharmakologie in Berlin. Dort leitet er seither die Abteilung für Molekulare Biophysik; parallel lehrt er an der Humboldt-Universität zu Berlin „Struktur und Dynamik von Biomolekülen“ im Rahmen einer W3-S Professur. Für seine Arbeit am FMP konnte der Strukturbiologe hohe Drittmittel-Summen einwerben. So erhielt er zunächst ein Emmy Noether-Stipendium der Deutschen Forschungsgemeinschaft (DFG); aktuell wird er mit einem Grant vom European Research Council (ERC) gefördert.
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!