Maßgeschneiderte Enzyme dank quantenchemischer Simulation
Simulation des Enzyms AsqJ zeigt neue Optionen für Wirkstoffherstellung
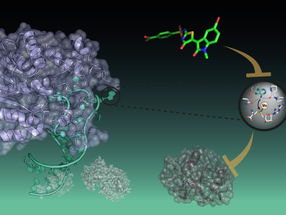
An nahezu allen biochemischen Prozessen sind Enzyme beteiligt, die chemische Reaktionen beschleunigen. Ein Forschungsteam der Technischen Universität München (TUM) hat jetzt erstmals den molekularen Mechanismus des Enzyms AsqJ entschlüsselt. Einsatzmöglichkeiten sehen sie beispielsweise in der Herstellung pharmazeutischer Wirkstoffe.
Ohne Enzyme käme die Natur zum Stillstand. Die winzigen Moleküle beschleunigen biochemische Reaktionen oder machen sie überhaupt erst möglich. Doch was geschieht dabei im Detail? „Die genaue Funktion von Enzymen zu verstehen ist eine der größten Herausforderungen der modernen Biochemie“, sagt Ville Kaila, Professor für Computergestützte Biokatalyse an der TU München.
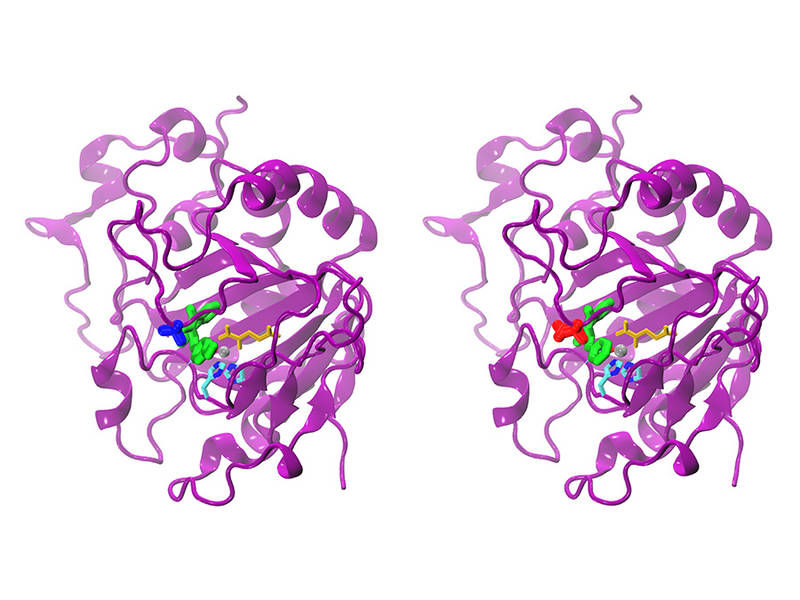
Natürliches (links) und modifiziertes AsqJ. Die beiden Enzyme unterscheiden sich lediglich dadurch, dass an Position 72 im natuerlichen ein Valin eingebaut ist (blau) und in der modifizierten Form ein Isoleucin (rot). Das Substrat im aktiven Zentrum ist gruen gefaerbt, alpha-Ketoglutarat gelb, das Eisenatom grau und zwei Histidinketten cyan und blau.
S. Mader / TUM
Ein Forschungsteam um Ville Kaila und Michael Groll, Professor für Biochemie an der TU München, entschlüsselte jetzt erstmals den Mechanismus des Enzyms AsqJ (Aspoquinolone J), einer Dioxygenase, die Sauerstoff für die Aktivierung von Kohlenstoffbindungen benutzt.
Ein Enzym – viele Reaktionen
Das Enzym AsqJ ist ein besonders spannender Kandidat für die Wissenschaft, weil es eine Kaskade chemischer Reaktionen katalysiert, die schließlich zur Bildung antibakterieller Wirkstoffe führt. Erst vor wenigen Jahren wurde es im Schimmelpilz Aspergillus nidulans entdeckt.
Um das Geheimnis des Enzyms zu lüften, kombinierten die Forschenden verschiedene Methoden: Im ersten Schritt ermittelten Alois Bräuer und Prof. Michael Groll mit Hilfe der Röntgenkristallographie die dreidimensionale atomare Struktur des Moleküls. Diese nutzten Erstautorin Sophie L. Mader und Ville Kaila im nächsten Schritt für die quantenmechanische Simulation der biochemischen Prozesse.
Mit Simulationen dem Geheimnis auf der Spur
„Unsere Berechnungen zeigen, wie das Enzym die Bildung antibakterieller Wirkstoffe, der Chinolon-Alkaloiden, katalysiert“, berichtet Kaila. „Erstaunlich ist dabei, welche Rolle winzige Details spielen: Eine geringfügige Veränderung des Substrats, nämlich die Entfernung einer kleinen Atomgruppe, bringt die Reaktion bereits zum Erliegen.“
Als nächstes simulierten das Team am Computer eine neue Variante des Enzyms, die auch mit dem veränderten Substrat die Bildung der Chinolon-Alkaloide katalysiert. Dieses neue Enzym wurde mit Hilfe von Bakterienkulturen hergestellt und auf seine Funktion getestet. „Das Ergebnis war beeindruckend: Schon nach wenigen Sekunden setzte die erwartete Reaktion ein“, erinnert sich Bräuer.
Computerdesign für neue Wirkstoffe
„Das Experiment zeigt, dass unsere Methode funktioniert und geeignet ist, auch die Funktion anderer Enzyme auf molekularem Niveau darzustellen“, so der Wissenschaftler. Noch sei das Enzym-Design Grundlagenforschung – diese habe jedoch ein enormes Potenzial. Ein Ziel künftiger Forschung werde es sein, Enzyme am Computer zu entwerfen, beispielsweise für die Produktion von Medikamenten.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.